|
|
On donne :
Tables I.R.
Liaisons
|
Vibration
|
Nombre d'onde (cm-1)
|
intensité
|
C=C
|
nCsp2-Csp2
|
vers 1650
|
M moyenne
|
C-H
|
nCsp2-H |
vers 3050
|
M moyenne
|
OH libre
|
nOH
|
entre 3500 et 3700
|
M ( bande fine)
|
OH lié
|
nOH |
entre 3100 et 3500
|
forte, bande large
|
C=O, cétone, aldehyde
|
nC=O
|
entre 1650 et 1740
|
F
|
C=O, ester
|
nC=O |
entre 1700 et 1750
|
F
|
N-H amine primaire
|
nN-H
|
1ère bande : 3300-3500
2ème bande : 3200 - 3400
|
M
M
|
N-H amine primaire
|
dN-H
|
1ère bande : 1550 - 1650
2ème bande : 650 -900
|
F
M, bande large
|
|
Calculer
la longueur d'onde l associée au nombre d'onde 3000 cm-1.
l = 1/3000 = 3,33 10-4 cm = 3,33 10-6 m = 3,33 µm.
Calculer l'énergie correspondante ( J et eV). h = 6,63 10-34 Js ; c = 3,00 108 m s-1. 1 eV = 1,60 10-19 J.
E = h c / l = 6,63 10-34 * 3,00 108/ ( 3,33 10-6)= 5,97 10-20 J.
5,97 10-20 / (1,60 10-19) =0,373 eV.
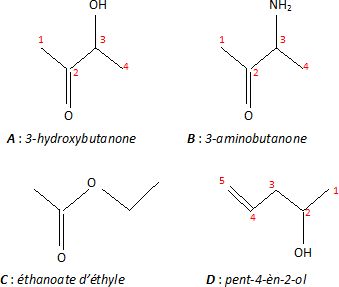
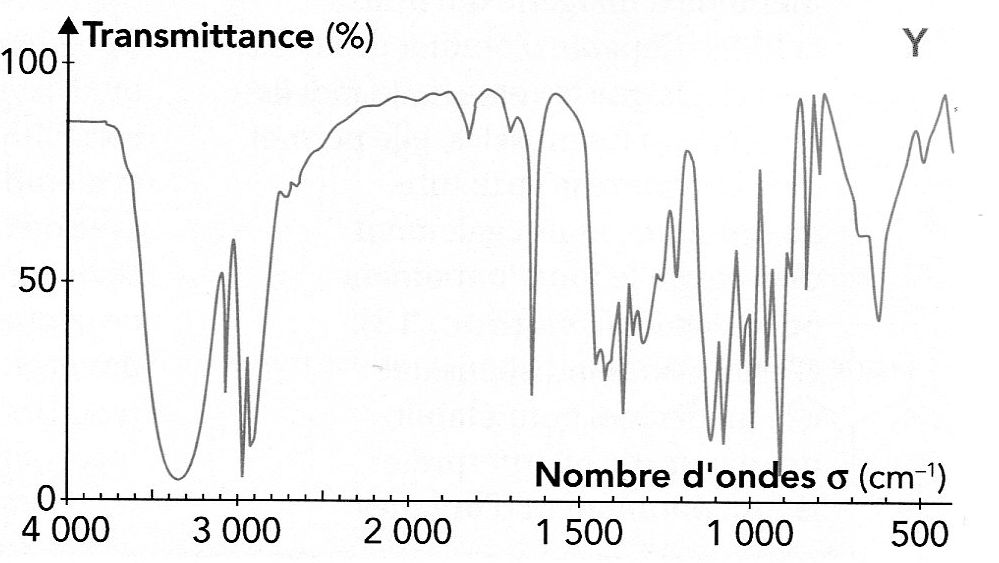
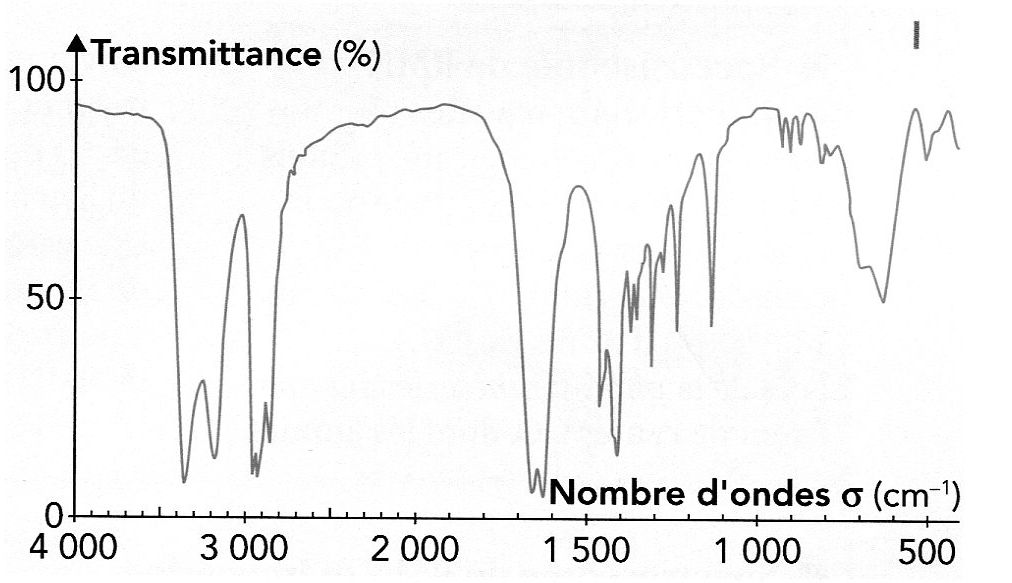
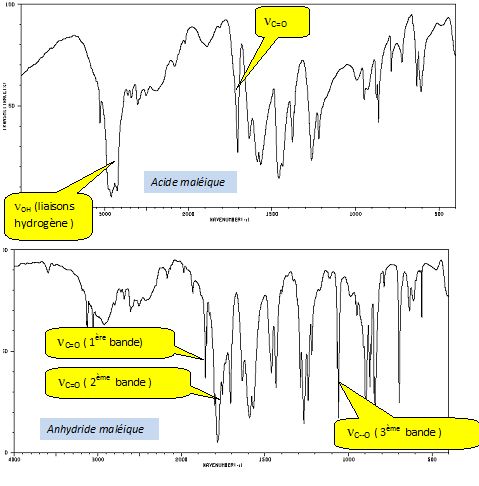
Atribuer chaque spectre à l'une des molécules A, B, C ou D en justifiant.
Spectre Y ( D ) : bande large vers 3400 cm-1 : liaison OH lié ( liaison hydrogène ) d'un alcool ; 1650 cm-1 : liaison C=C, vibration.
Absence de la bande caractéristique de la vibration C=O vers 1700 cm-1.
Spectre I ( B ) : 1ère bande : 3300-3500 cm-1 ; 2ème bande : 3200 - 3400 cm-1 ; 1ère bande : 1550 - 1650 cm-1et 2ème bande : 650 -900 cm-1 ( amine primaire ).
C=O, cétone, vers 1670 cm-1.
|
On donne :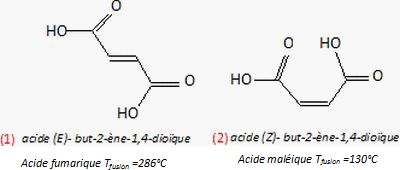 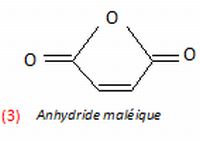
Définir et illustrer par un schéma les termes suivants :
Doubles liaisons conjuguées et couleur des molécules.
Une
alternance de double liaisons et de simples liaisons constitue un
système de doubles liaisons conjuguées. Les doubles liaisons absorbent
la lumière.
La longueur d'onde de la lumière absorbée augmente avec le nombre de
liaisons conjuguées. La couleur perçue est la couleur complémentaire
des radiations absorbées.
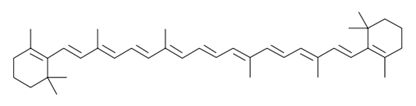
Une molécule organique possédant un système conjugué d'au moins 7
liaisons doubles ( en absence de groupes caractéristiques ) constitue
un système coloré.
Le b-carotène dont la molécule possède 11
doubles liaisons conjuguées, absorbe la lumière bleue. Il a une couleur
orange.
Liaison hydrogène.
Les atomes d’azote et surtout d’oxygène possèdent respectivement deux
et quatre électrons externes non liants. Ceci leur confère un caractère
nucléophile.
Ils peuvent exercer une attraction sur les atomes électrophiles
voisins, en particulier les atomes d’hydrogène : cette attraction
constitue une liaison hydrogène.
Cette liaison est 20 fois plus faible qu'une liaison covalente classique.
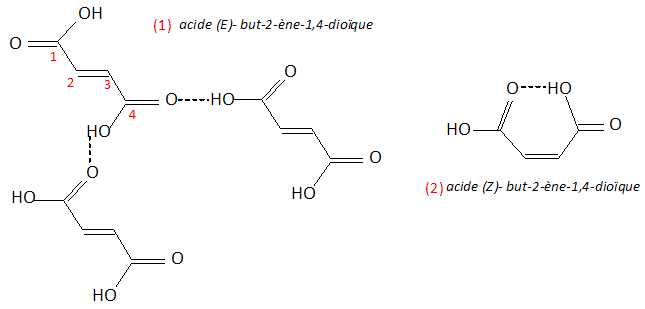
Liaison hydrogène ( en pointillé ) : (1) intermoléculaire ; (2) intramoléculaire.
Conséquence sur les températures de fusion : la température de fusion
de l'acide maléique (2) est de 130°C, bien inférieure à celle de
l'acide fumarique (1).
La présence de liaison hydrogène intramoléculaire diminue les interactions intermoléculaires, donc la température de fusion.
Isomères :
Deux isomères ont la même formule brute mais des formules semi-développées différentes.
L'acide fumarique (1) et l'acide maléique (2) sont isomères. L'acide maléique et l'anhydride maléique ne sont pas des isomères.
Différencier les spectres IR de l'acide maléique et de l'anhydride maléique.
|
RMN composés de formule brute C4H10O.
Donner le nom et la formule semi-développée de tous les isomères.
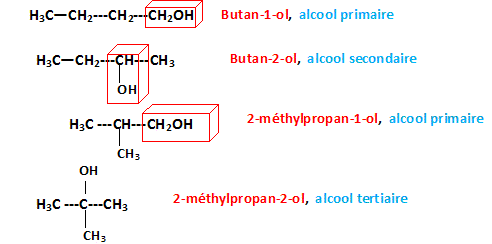
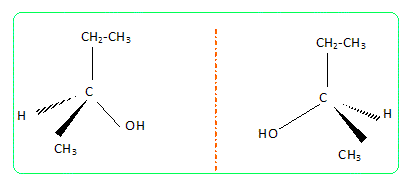
Le butan-2-ol possède un carbone
asymétrique, d'où le couple
d'énantiomères :
H3C-O-CH2-CH2-CH3 : méthoxypropane ou méthylpropyl éther ;
H3C-O-CH(CH3 )2 : 2-méthoxypropane ou méthylisopropyl éther ;
H3C-CH2-O-CH2-CH3 : éthoxyéthane ou diéthyl éther ;
(R+Rq)i2
= V d'où i2 = V /
(R+Rq).
V = Ri1 + Rq
i2 = Ri2 + Rq
i2 ; par suite i1 = i2.
Attribuer une molécule à chaque spectre en justifiant.
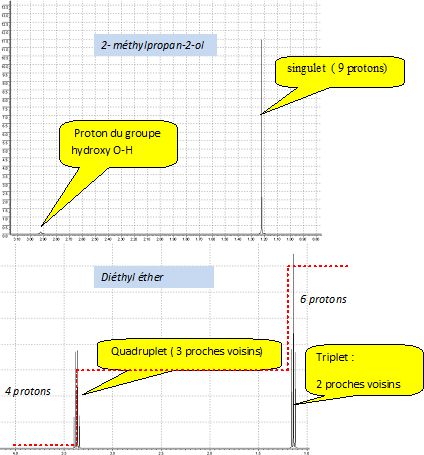
En pointillés rouges, la courbe d'intégration.
|
|










