|
|
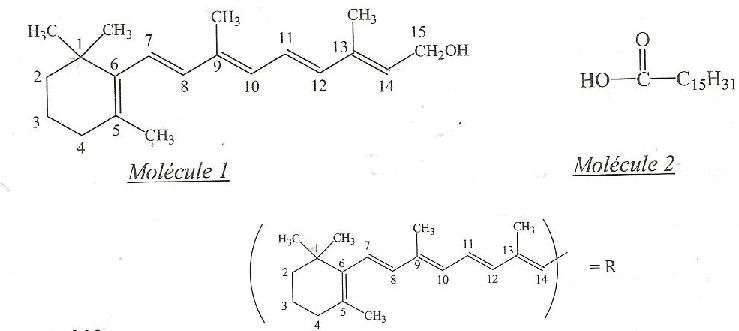
La vitamine A (
molécule 1) est indispensable à la vie animale puisqu'elle intervient
dans de nombreux processus biologiques, dont celui de la vision.
L'homme étant incapable de la synthétiser, son apport se fait par
l'alimentation, principalement sous forme d'esters, dont le principal
est le palmitate de rétinyle, contenus dans le lait, les laitages, le
jaune d'oeuf, le foie de poisson.
Une fois assimilé, le palmitate de rétinyle est stocké dans le foie,
avant d'être hydrolysé pour donner de l'acide palmitique ( molécule 2)
et de la vitamine A qui sera transportée dans le sang.
La fonction
caractéristique de la vitamine A est une fonction :
A) Acide carboxylique ; B) Alcool ; C) Aldehyde ; E) Anhydride d'acide
; E) Ester.
R-CH2OH : alcool primaire.
La molécule 3 est issue de la réaction entre les molécules 1 et 2.
A) La formule de la molécule 3 est : 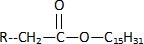 Faux. Faux.
B) La formule de la molécule 3 est :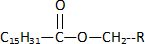 Vrai. Vrai.
C) L'équation bilan de la réaction d'hydrolyse est :
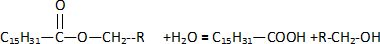 Vrai. Vrai.
D) L'équation bilan de la réaction d'hydrolyse
est :
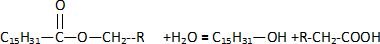 Faux. Faux.
Concernant l'hydrolyse de la molécule 3 :
A) Il s'agit d'une réaction totale. Faux.
L'hydrolyse est limitée
par la réaction inverse, l'estérification.
B) Il s'agit d'une réaction rapide. Faux.
C) Son équilibre peut être déplacé vers la formation du rétinol par
élimination d'eau. Faux.
Par élimination d'eau
l'équilibre est déplacé dans le sens indirect.
D) Sa vitesse peut être augmentée en milieu acide. Vrai.
E) Sa vitesse peut être augmentée en augmantant la température. Vrai.
|
.
|
Une fois dans
la circulation sanguine, la vitamine A est transportée vers les
différents organes, dont les yeux, où elle s'accumule dans les
bâtonnets, cellules tapissant la rétine. Là, sous l'action d'une enzyme
appelée rétinol déshydrogénase, elle est transformée par le NAD+
en molécule 4, selon l'équation :
R-CH2OH + NAD+ ---> R-CHO ( molécule 4 ) +
NADH + H+.
Nommer
le groupe fonctionnel de la molécule 4. Groupe aldehyde.
Ecrire
la demi-équation de transformation de la molécule 1 en molécule 4.
R-CH2OH =
R-CHO + 2H+ + 2e-.
Quelle
est, de la molécule 1 ou de la molécule 4, l'espèce oxydante ?
Couple oxydant / réducteur : R-CHO / R-CH2OH
; R-CHO est la forme oxydante.
Ecrire
la demi-équation d'oxydo-réduction donnant NADH à partir de NAD+.
NAD+ + H+
+ 2e- = NADH.
S'agit-il
d'une oxydation ou d'une réduction ?
NAD+
gagne des électrons, c'est un oxydant qui se réduit.
L'humeur aqueuse, liquide biologique de l'intérieur de l'oeil présente
une concentration non négligeable en lactate, produit de la réaction
ci-dessous catalysée par la lactate déshydrogénase (LDH) au niveau du
cristallin.
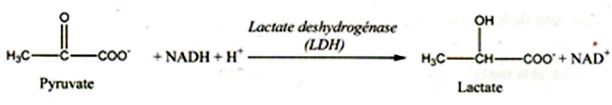
Pour suivre l'évolution de la concentration en NADH, on
effectue in vitro un dosage de cette réaction par spectrophotométrie,
dans les conditions de validité de la loi de Beer-Lambert. NADH et NAD+
possèdent respectivement le spectre d'absorption suivant :
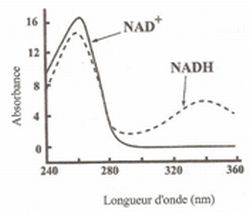
A quelle longueur
d'onde faut-il se placer pour effectuer le suivi cinétique de cette
réaction par spectrophotométrie ? Justifier.
Il faut qu'une seule espèce présente un maximum d'absorption à la
longueur d'onde choisie. Vers 340 nm, ( domaine U.V ) seule NADH
présente un maximum d'absorption.
D'après
le spectre ci-dessus quelle est la couleur de la solution ? Justifier.
Si les deux espèces ne présentent pas de maximum d'absorption dans le
domaine visible [ 400 nm - 800 nm ], la solution est incolore.
L'acide oxamique est un inhibiteur de la LDH.
Expliquer
brièvement en quoi la présence d'acide oxamique impacte le
fonctionnement des cellules des bâtonnets de la rétine.
NADH ne peut plus être réduit en NAD+ et en absence de ce
dernier, R-CH2OH ne peut être oxydé en R-CHO.
A propos de la méthode de dosage utilisé :
A) Ce mode opératoire nécessite la construction préalable d'une droite
d'étalonnage. Vrai.
B) Cette méthode de dosage est non destructive. Vrai.
C) On ne peut pas effectuer une mesure à 260 nm à cause de la propriété
d'additivité des absorbances. Vrai.
D) L'absorbance mesurée est inversement proportionnelle à la
concentration de la solution. Faux.
L'absorbance et la
concentration molaire sont proportionnelles.
E) Pour être dans le domaine de validité de la loi de Beer-Lambert, il
faut que le spectrophotomètre émette de la lumière blanche. Faux.
Lumière blanche et/ ou
lumière UV pour les mesures quantitatives.
En utilisant une cuve de longueur L=1,0 cm, les mesures d'absorbances
sur 4 solutions de NADH, H+ ont permis d'obtenir les
résultats suivants :
[NADH,H+]
(mmol/L)
|
6,0
|
4,0
|
2,0
|
0,5
|
A
|
37,32
|
24,88
|
12,44
|
3,11
|
| A
/ ([NADH,H+] L) ( mmol-1 L cm-1 ) |
37,32
/ (6,0 *1,0) = 6,2
|
24,88
/4 =6,2
|
12,44
/ 2 =6,2
|
6,2
|
On en déduit que le coefficient d'extinction molaire e de NADH, H+ vaut :
3,1 mol-1L cm-1 ; 6,2 mmol-1L cm-1
; 3,1 mol-1L cm ; 6,2 mol-1L cm-1 ;
6,2 103 mol-1L cm-1 ;
e = 6,2 mmol-1
L cm-1 = 6,2 103 mol-1L cm-1.
A) Le coefficient d'extinction molaire dépend de la longueur d'onde de
la lumière utilisée. Vrai.
B) Le coefficient d'extinction molaire est indépendant de la nature de
la solution. Faux.
C) La loi de Beer n'est pas valide si on utilise de la lumière visible.
Faux.
D) L'absorbance s'exprime en mol-1L cm-1. Faux.
L'absorbance est sans
unité.
E) La loi de Beer fait intervenir le volume de la cuve traversée par la
lumière. Faux.
Cette loi fait intervenir
la longueur de la cuve traversée par la lumière.
|
On mesure la
concentration en acide lactique ( M = 90,0 g/mol) sanguin ( acide
conjugfué ion lactate ), d'un athlète après une course de 800 m. On
prélève V = 1,0 mL de sang et on en extrait la totalité de l'acide
lactique. Cet acide est introduit dans une fuiole jaugée de 50,0 mL
contenant un peu d'eau distillée. On agite jusqu'à dissolution
complète. On complète la fiole jaugée avec de l'eau distillée jusqu'au
trait de jauge. On appelle S la solution obtenue.
On réalise le dosage du volume VA = 50,0 mL de la solution S
par une solution aqueuse de soude de concentration molaire cB
= 1,00 10-3 mol/L. L'équivalence est atteinte pour un volume
de solution de soude VE = 20,0 mL
La constante d'équilibre de la réaction entre les ions hydroxydes et
'acide lactique vaut K = 1,0 1010 à 25°C.
Que
peut-on déduire de la valeur de K.
K est très grande, la réaction est quantitative, totale.
Donner
l'équation de la réaction de titrage en utilisant les formules
semi-développées.
HO-aq + CH3-CH(OH)-COOHaq ---> CH3-CH(OH)-COO-aq
+ H2O.
Etablir
l'expression du Ka du couple ( acide lactique / ion lactate) en
fonction de K puis calculer sa valeur.
On note AH l'acide lactique et A- l'ion lactate. Ka
= [A-][H3O+] / [AH] soit [A-] /[AH] = Ka / [H3O+].
K = [A-]/ ([AH][HO-aq]) = Ka / ([H3O+][HO-aq] = Ka /
10-14 ; Ka = 10-14 K =
10-4.
Le pKa du couple ( acide
lactique / ion lactate) vaut : 2 ; 3 ; 4 ; 6 ; 8.
pKa = - log (Ka) = - log 10-4 = 4.
La
concentration molaire en acide lactique dans la solution S vaut :
1,00 10-4 mol/L ; 2,00 10-4 mol/L ; 2,00 10-3 mol/L ; 4,00 10-3 mol/L ; aucune
réponse juste.
A l'équivalence VA[AH] = cB VE ; [AH]
= cB VE / VA = 1,00 10-3
*20 / 50 =4,00 10-4 mol/L.
La
concentration massique en acide lactique dans le prélevement sanguin
vaut :
9,0 g/L ; 3,6 g/L ; 3,6 mol/L ; 1,8 g/L ; 0,90 g/L.
Dans 50 mL de solution S il y a : VA[AH] = 0,050 *4,00 10-4
= 2,0 10-5 mol d'acide lactique.
Concentration de l'acide lactique dans le sang : c = 2,0 10-5
/ 10-3 =2,0 10-2 mol/L.
c M = 2,0 10-2
*90 = 1,8 g/L.
|
|