|
|
Chimie générale.
Une solutuion à pH=2 est-elle ?
acide, neutre, basique.n.
Quel est le pH d'une solution de soude de concentration c = 0,01 mol/L ?
[HO-] = 0,01 mol/L ; [H3O+] = 10-14 / [HO-] = 10-14 / 0,01 = 10-12 mol/L ; pH = - log 10-12 = 12 à 25°C.
Préparation de solution de phtalate acide de potassium.
Décrire la préparation de la gamme étalon ( dans des fioles de 100 mL ) de phtalate acide de potassium ( C8H5KO4 M = 204,22 g/mol ) suivante :
solution a : 0,5 ppm de carbone.
Pourcentage massique du carbone : 8*12 / 204,22 =0,4700 ( 47,00 % ).
Quantité de matière de phalate acide de potassium : 0,5 / 0,47 =1,064 ppm.
Soit 1,064 mg de phtalate de potassium dans 1 L d'eau ou 0,1064 mg dans 100 mL d'eau.
Peser
sur une balance de précision cette masse de solide, introduire dans une
fiole jaugée de 100 mL, dissoudre dans de l'eau distillée et compléter
jusqu'au trait de jauge avec de l'eau distillée.
solution b : 1 ppm de carbone. ( même méthode avec 2*0,1064 =0,213 mg ).
solution c : 1,5 ppm de carbone. ( même méthode avec 3*0,1064 =0,319 mg ).
Ou bien préparer la solution c, puis pour obtenir la solution b, diluer 1,5 fois ; pour obtenir la soution a, diluer 3 fois.
Donner l'équivalent de ces solution exprimées en µM de carbone.
1,064 mg de phtalate de potassium dans 1 L d'eau, soit 1,064 10-3 / 204,22 = 5,21 10-6 mol = 5,21 µM de phtalate.
Cela correspond à : 0,47*5,21 = 2,45 µM de carbone pour la solution a.
Préparation d'une solution d'acide chlorhydrique de concentration
connue à partir d'une solution commerciale à 37 %, de densité 1,19.
Masse molaire de HCl = 36,5 g/mol.
Où devez vous trouver ces informations ainsi que les pictogrammes de sécurité ?
Sur l'étiquette portée par la bouteille d'acide chlorhydrique du commerce.
Déterminer la molarité de l'acide.
Masse d'un litre de solution : 1,19 kg = 1,19 103 g. Masse d'acide pur : 0,37 *1,19 103 = 440,3 g.
Quantité de matière d'acide : 440,3 / 36,5 = 12,06 ~12,1 mol dans 1 L.
Comment préparez-vous 250 mL d'une solution d'HCl à 2,35 M à partir de cette solution commerciale :?
Facteur de dilution F = 12,1 / 2,35 = 5,13.
Volume de solution mère à prélever à l'aide d'une pipette jaugée ou d'une burette graduée : 250 / 5,13 = 48,7 mL.
Utiliser une fiole jaugée de 250 mL contenant un peu d'eau distillée, y
verser la prise et compléter avec de l'eau distillée jusqu'au trait de
jauge. Boucher et agiter pour rendre homogène.
|
A quels éléments correspondent les symboles chimiques suivants :
Br : brome ; Sn : étain ; I : iode ; Ar : argon ; W : tungstène ; N : azote.
Equilibrer la réaction suivante :
I2 +2 S2O32- = 2 I- + S4O62-.
Ecrire les deux équations des deux couples redox mis en jeu dans la réaction précédente.
I2 +2 e- = 2 I- ; 2 S2O32- =S4O62-+2 e-.
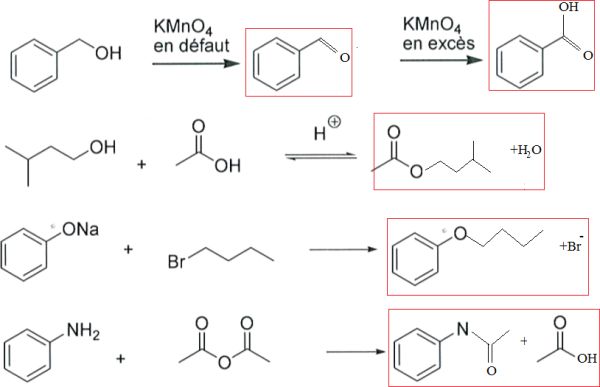
Compléter les réactions suivantes :
Faire
le schéma d'un montage de distillation classique sous vide équipé d'un
collecteur de fractions, en précisant le nom de chaque matériel.
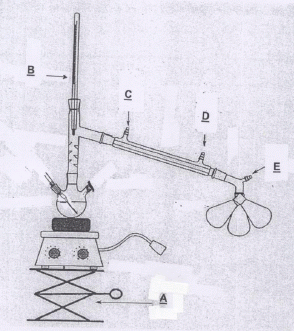
Montage de distillation fractionnée sous pression réduite.
A : élévateur à croisillons ; B : thermomètre ; C : sortie de l'eau ; D : entrée de l'eau ; E : vers la trompe à eau.
|
Ecrire la loi de Beer-Lambert reliant la concentration, le coefficient d'extinction molaire e, la chemein optique, l'intensité incidente I0 et transmise I. Préciser les unités ?
Dans le cas des solutions, la loi de Beer fait intervenir
les concentrations.
I = I0 . e (-
elc)
où e
est un coefficient caractéristique de la
substance appelé coefficient d'absorbance
(L mol-1
cm-1),
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la solution
(mol/L).
Cette loi est vérifiée lorsque la solution
est de concentration inférieure à : c < 0,1
mol.L-1.
La relation fondamentale utilisée en
spectrophotométrie est présentée sous
la forme :
A= log (I0/I) =
elc
( A est
l'absorbance
ou densité
optique).
La transmission T est définie comme le
rapport de l'intensité transmise à
l'intensité incidente.
T = I /
I0 ; log T= -A.
L'absorbance et la transmitance, rapport de deux intensités lumineuses, sont sans unité.
La mesure de l'absorbance d'une solution d'un composé est A = 0,2 ; son coefficient d'absorption molaire est de 20 000 cm-1 mol-1 L ; le chemin optique est de 10 cm.
Calculer sa concentration.
C = A / (e l) =0,2 / (20 000*10) = 1,0 10-6 mol/L.
Compléter le tableau suivant :
Formule
|
Nom
|
Formule
|
Nom
|
CH3COOH
|
acide éthanoïque
|
FeCl2
|
chlorure derreux
|
KMnO4
|
permanganate de potassium
|
H2O2
|
peroxyde d'hydrogène
|
C6H5-CH3
|
toluène
|
CH3OH
|
méthanol
|
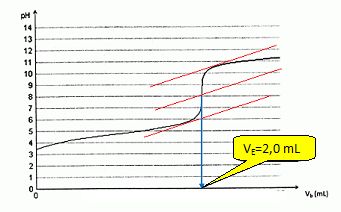
On se propose de faire le dosage d'une solution acide d'un volume
total de 10 mL et contenant de l'acide acétique à 0,01 M. La solution
de titrage est une solution de soude à 0,05 M.
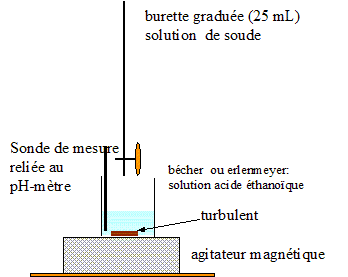
Tracer la courbe de titration et définir le point équivalent. Dessiner le montage correspondant à ce dosage.
Ecrire l'équation support du dosage. Quels sont le volume équivalent et le pH.
Indiquer le pH au départ, à la demi-équivalence et à 2 fois le volume équivalent.
A
l'équivalence les quantités de matière des réactifs sont en proportions
stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès,
après l'équivalence, l'autre réactif est en escès. CH3COOH +HO- ---> CH3COO- + H2O.
VE = CA VA / CB = 10 *0,01 / 0,05 = 2,0 mL. pHéquivalent ~ 8.
pHinitial ~ 3,4 ; pH demi-équivalence = pKa = 4,8 ; pH2Ve ~12.
Vous disposez d'un flacon d'acide acétique 1 N certifié et de la soude en pastille ( M = 40 g/mol).
Décrire les protocoles pour préparer la solution titrante et la solution titrée.
Port de blouse, lunette et gants.
Solution titrée, acide acétique à 0,01 M. Le facteur de dilution est égal à 100.
Prélever 10,0 mL de solution à 1 M à l'aide d'une pipette jaugée.
Verser dans une fiole jaugée de 1,00 L contenant environ 500 mL
d'eau distillée. Compléter jusqu'au trait de jauge avec de l'eau
distillée. Boucher et agiter pour rendre homogène.
Solution titrante, soude à 0,05 M. Quantité de matière de soude dans 1 L : 0,05 mol.
Masse de solide à peser sur une balance de précision : 40 *0,05 = 2,0 g.
Verser ce solide dans une fiole jaugée de 1,00 L. Ajouter de l'eau
distillée, agiter pour dissoudre le solide. Compléter jusqu'au trait de
jauge avec de l'eau distillée. Boucher et agiter pour rendre homogène.
|
Connaissances générales.
Que signifie les sigles suivants ?
Laboratoire
E A : laboratoire en cours d'évaluation ; Laboratoire U M R : unité
mixte de recherche ; L R U : loi sur l'autonomie des
universités ; A E R E S : agence d'évaluation de la
recherche de l'enseignement supérieur..
Quels sont les trois conseils centraux d'une université ?
Le conseil d'administration, le conseil scientifique, le conseil des études et de la vie universitaire.
Quels sont la nationalité et le nom de jeune fille de Marie Curie ?
Polonaise ; Maria Salomea Skłodowska.
Décrire ce qu'est un impact factor( F I ) et son usage en recherche.
Le
FI d'un journal est le nombre moyen de citations de chaque article
publié dans ce journal. Il sert de critère d'évaluation quantitatif.
Sécurité, santé au travail.
Quelle est la signification des pictogrammes suivants.

A quoi correspond le n° CAS et à quoi sert-il ?
Le numéro CAS d'un produit chimique est son numéro d'enregistrement unique auprès de la banque de données de Chemical Abstracts Service. Le but est de faciliter les recherches dans les bases de données.
Qu'est-ce qu'une phrase de risque ?
Ce sont desannotations présentes sur les étiquettes des produits chimiqes qui indiquent les risques encourus lors de leur utilisation ou de leur rejet dans l'environnement.
Lorsqu'on dilue un acide concentré, il faut :
Verser l'eau dans l'acide. ( faux) ; verser l'acide dans l'eau et
chauffer la solution qui en résulte ( faux) ; verser petit à
petit l'acide dans l'eau tout en refroidissant l'ensemble ( vrai) ; on
ne dilue jamais un acide c'est trop dangereux ( faux).
Que faut-il faire lorsqu'une personne reçoit de la soude concentrée dans l'oeil ?
On
rince abondamment à l'eau puis on l'accompagne à l'infirmerie ( vrai )
; on neutralise avec de l'acide faible le plus rapidement possible (
faux ) ; on demande à la personne de fermer l'oeil puis on l'accompagne
à l'infirmerie ( faux ).
|
|