|
|
Préparation de solutions.
On désire préparer 3 L de solution d'acide sulfurique à 0,05 M.
Masse volumique de l'acide sulfurique à 95 % : r = 1,84 g/L.
Quelle est la différence entre la normalité N et la molarité M d'une solution ?
Une solution est normale lorsqu'elle contient potentiellement sous forme libre ou susceptible d'être libérée une mole d'ions H+ par litre.
Concentration molaire ( encore appelée molarité) : une solution contient une mole de soluté par litre de solution.
Donner le titre de l'acide sulfurique en normalité.
0,05 mol/L soit 0,05*2 = 0,1 N.
Donner la formule brute et le schéma de Lewis de l'acide sulfurique. H2SO4.
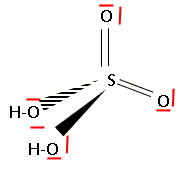
Calculer la masse molaire de l'acide sulfurique.
M = 2+32+4*16 = 98 g/mol..
Quel
volume V d'une solution commerciale d'acide sulfurique à 95 % en masse
faut-il pour préparer les 3 L de solution d'acide sulfurique à 0,05 M ?
Masse d'acide sulfurique pur par litre : 1,84 *0,95 = 1,748 kg = 1748 g.
Quantité de matière en mol : 1748 / 98 = 17,84 mol dans un litre.
Facteur de dilution : 17,84 / 0,05 =357.
Volume de solution commerciale à prélever : 1000 / 357 = 2,8 mL pour préparer un litre de solution à 0,05 M
V = 3*2,8 = 8,4 mL.
Assurance qualité au laboratoire.
Citer la norme internationale qui spécifie les exigences de qualité et
de compétence propres aux laboratoires d'essais et d'analyses.
ISO/CEI 17025.
Quel est le nom de l'organisme qui accrédite sur demande les laboratoires d'essais et d'analyses selon cette norme ?
COFRAC.
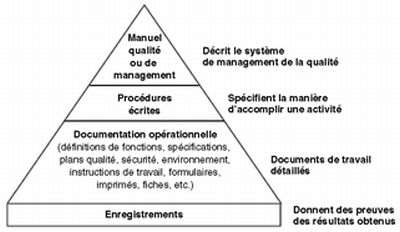
Dessiner la pyramide documentaire des différents documents qualité.
|
.
|
Alcoolémie.
Quelle
est l'alcoolémie autorisée en France pour un conducteur ? A partir de
quelle alcoolémie l'infraction est considérée comme un délit ?
Il est interdit de conduire avec un taux d'alcool dans le sang supérieur ou égal à 0,5 g par L de sang.
Conduire avec un taux d'alcool supérieur à 0,8 g par litre de sang constitue un délit.
Quel est le principe de fonctionnement des éthylomètres numériques utilisés par les forces de police ?
Les
éthylotests électroniques comportent une sonde sensible au taux
d’alcool dans l’air expiré. Lorsque que la quantité d'alcool dépasse le
taux légal en vigueur, un signal sonore retentit.
Un courant se crée lorsque la présence de molécules d’alcool dans
l’haleine est assez importante. L'intensité du courant est liée à la
quantité d'alcool dans l'air expiré. Le semi-conducteur du dispositif
laisse alors passer le courant généré jusqu'à un microprocesseur qui
l'évalue et le convertit en une mesure lisible sur le cadran.
Suite à un alcootest positif un automobiliste subit une prise de sang. On prélève 10,0 mL de sang.
Pour oxyder l'éthanol contenu dans cet échantillon, on y ajoute un peu
d'acide sulfurique, une solution de dichromate de potassium K2Cr2O7 en excès de concentration 0,010 mol/L et de volume 20,0 mL. L'un des couples qui intervient est Cr2O72-/Cr3+.
Le dichromate en excès est dosé par une solution d'iodure de potassium
de concentration 0,020 mol/L. L'équivalence est obtenue pour 24 mL de
cette dernière solution. L'un des couples qui intervient est I2/I-.
Quelles sont les deux méthodes officielles de dosage de l'éthanol dans le sang ? Donner le principe d'une des 2 méthodes.
Chromatographie en phase gazeuse.
Méthode de Cordebard ( distillation, oxydation )
On sépare l’alcool par distillation en ayant au préalable traité un échantillon de sang.
On récupère l’alcool par distillation puis on l’oxyde par des ions
dichromates en excès. Cet excès sera doser en retour par l’iodométrie.
Préciser le nom, la nature et la formule semi-développée du produit formé lors de l'oxydation de l'éthanol.
Acide éthanoïque ( acide carboxylique) 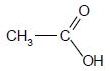
Ecrire
les demi-équations électroniques relatives aux trois couples
oxydo-réducteur. En déduire les équation bilan des réactions
d'oxydo-réduction.
3 fois {
C2H5OH
+H2O =
CH3COOH +
4H+ + 4e-
}
oxydation alcool.
2 fois {
Cr2O72-
+ 14H+ + 6e-
= 2Cr3+ + 7
H2O
} réduction de l'ion
dichromate.
3C2H5OH +
2Cr2O72-
+16H+=
3CH3COOH + 4Cr3+ + 11
H2O
(1)
3 fois { 2I- =
I2+ 2e-
}
oxydation des ions iodure.
Cr2O72-
+ 14H+ + 6e-
= 2Cr3+ + 7
H2O. réduction de l'ion
dichromate.
Cr2O72-
+ 14H+ + 6I-
= 3I2+ 2Cr3+ + 7
H2O. (2)
|
|
Déterminer le nombre de moles d'ion dichromate utilisé pour l'oxydation de l'éthanol.
Quantité de matière d'ion dichromate initiale : n0 =0,010 * 20 10-3 =2,0 10-4 mol.
Quantité de matière d'ion iodure à l'équivalence n(I-) = 0,020 * 24 10-3 =4,8 10-4 mol.
Quantité de matière d'ion dichromate en excès : nexcès = n(I-) /6 =4,8 10-4 /6 =8,0 10-5 mol.
Quantité de matière d'ion dichromate utilisé pour oxyder l'éthanol : nutile = n0 -nexcès =2,0 10-4 -8,0 10-5 =1,2 10-4 mol.
Déterminer la concentration molaire et massique de l'éthanol et conclure.
Quantité de matière d'éthanol : n =1,5 nutile =1,5 *1,2 10-4 =1,8 10-4 mol dans 10,0 mL de sang.
Soit 1,8 10-2 mol d'éthanol par litre de sang.
M(éthanol) = 46 g/mol.
1,8 10-2 *46 =0,83 g d'alcool par litre de sang.
Le conducteur a commis un délit.
|
|