|
|
Expliquer le
principe général de la chromatographie.
La chromatographie est
une méthode de séparation et d'identification des constituants d'un
mélange.
La chromatographie est basée sur
la différence de solubilité d'une substance dans deux phases non
miscibles : la phase stationnaire liée au support et la phase mobile ou
solvant.
Plus une substance est soluble dans la phase mobile, plus elle est
entraînée par cette phase; inversement, une substance peu soluble dans
la phase mobile migre peu.
Un fluide appelé phase mobile parcourt un tube appelé colonne. Cette
colonne peut contenir des "granulés" poreux (colonne remplie) ou être
recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les
deux cas, la colonne est appelée phase stationnaire.
A l'instant initial, le mélange à séparer est injecté à l'entrée de la
colonne où il se dilue dans la phase mobile qui l'entraîne à travers la
colonne. Si la phase stationnaire a été bien choisie, les constituants
du mélange, appelés généralement les solutés, sont inégalement retenus
lors de la traversée de la colonne.
De ce phénomène appelé rétention
il résulte que les constituants du mélange injecté se déplacent tous
moins vite que la phase mobile et que leurs vitesses de déplacement
sont différentes. Ils sont ainsi élués de la colonne les uns après les
autres et donc séparés.
Un détecteur placé à la sortie de la colonne couplé à un enregistreur
permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige
sur un enregistreur un signal constant appelé ligne de base en présence
du fluide porteur seul ; au passage de chaque soluté séparé il conduit
dans le temps à l'enregistrement d'un pic.
Dans des conditions chromatographiques données, le "temps de rétention"
(temps au bout duquel un composé est élué de la colonne et détecté),
caractérise qualitativement une substance. L'amplitude de ces pics, ou
encore l'aire limitée par ces pics et la prolongation de la ligne de
base permet de mesurer la concentration de chaque soluté dans le
mélange injecté.
C'est en jouant sur la nature de
l'éluant (et dans une moindre mesure sur la nature du support) que l'on
parvient à séparer les constituants d'un mélange.
Donner le nom de
chaque numéro correspondant à un des constituants du chromatographe en
phase gazeuse.
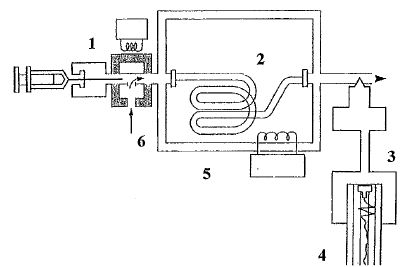
1 : injecteur ; 2 : colonne ; 3 : détecteur ; 4 : intégrateur ou
ordinateur ; 5 : thermostat de colonne ; 6 : gaz vecteur.
Quels
sont les principaux gaz vecteurs utilisables en chromatographie en
phase gazeuxe ?
Hydrogène, hélium, azote.
Quelles
sont les précautions à prendre vis-à-vis de ces gaz pour ne pas
endommager la colonne ?
Le gaz vecteur doit être pur, inerte (il ne doit pas réagir avec les
constituants de l'échantillon à séparer) et non miscible possible avec
la phase stationnaire.
|
.
|
Qu'est-ce qu'une
injection en mode "split" ? Quelle est la différence avec une injection
en mode "splitless" ?
Les injecteurs peuvent fonctionner suivant
deux modes, avec ou sans division (encore appelés split ou splitless).
En
mode split, le gaz vecteur pénètre avec un grand débit dans la chambre
de vaporisation ; une vanne de fuite sépare le courant gazeux en deux
parties : seule la plus petite pénétre dans la colonne.
Ce mode est utilisé dans les colonnes capillaires à faible débit. Le
mode splitless est utilisé dans le cas d'échantillons très dilués.
Citer
deux détecteurs couplés à la chromatographie en phase gazeuse.
Expliquer brièvement leur principe de fonctionnement.
Le
spectromètre de masse en aval de la colonne capture, ionise,
accélére, dévie et enfin détecter les espèces ionisées. Le spectromètre
de masse casse chaque molécule en fragments ionisés et détecte ces
fragments en fonction de leur rapport masse sur charge.
Les 4 parties principales d'un
spectromètre de masse sont :
Source d'ion : production d'ions en phase gazeuse.
Analyseur m / z : séparation des ions produits en fonction du rapport
masse / charge ( m / z).
Détection : conversion d'un courant ionique en courant électrique.
Traitement du signal : représentation des données sous forme d'un
spectre de masse.
Ces deux appareils utilisés ensemble, permettent l'identification
d'une substance sans aucune ambiguité.
Détecteur UV-visible : soumis à l'influence
d'un rayonnement lumineux, certains groupements fonctionnels d'une
molécule peuvent être le siège d'une excitation électronique c'est à
dire une absorption d'énergie, spécifiques du groupement fonctionnel.
Les résultats des analyses ont permis d'identifier de la propanone dans
le liquide faisant l'objet du scellé.
A quelle famille
chimique appartient la propanone ? Quel est son nom usuel ? Donner le
schéma de Lewis de cette molécule.
La propanone ou acétone appartient à la famille des cétones. 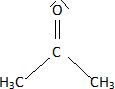
La fiche de sécurité de la propanone comporte deux pictogrammes de
danger.

Quelle est la
signification de chaque pictogramme ?
Inflammable pour le
premier et pour le second produits pouvant, selon le cas, entraîner les
effets suivants : empoisonnement, irritation, allergies cutanées,
somnolence, vertige.
Les résultats des analyses ont permis d'identifier du gasoil dans le
liquide faisant l'objet du scellé n°2. Le gasoil est constitué de
nombreux alcanes linéaire, avec notamment les composés phytane et
pristane.
Donner
la formule générale d'un alcane linéaire.
CnH2n+2 avec n entier supérieur ou égal à 1.
Les alcanes peuvent être synthétisés à partir d'alcènes.
Quel
est le type de réaction ? Donner un exemple de synthèse d'un alcane.
Addition de dihydrogène en présence d'un catalyseur : Nickel de Ranaey
ou de Sabatier.
CnH2n + H2 ---> CnH2n+2.
Le nom officiel du pristane est 2, 6, 10,14-tétraméthyl-pentadécane.
Donner
la formule brute du pristane et écrire sa formule topologique.
C19H40. 
Quelle
différence y-a-t-il entre le gasoil et le fuel domestique ? Comment
peut-on les différencier chimiquement ?
Chimiquement,
le fioul et le gazole diffèrent par leur teneur en cétane.
Le fioul domestique contient un colorant rose-rouge. Le gasoil,
carburant automobile est clair.
|
|
Des tests bandelettes permettent de
mettre en évidence de grandes quantités d'ion nitrate et potassium.
Citer
une technique analytique qui permettrait de confirmer ce résultat ?
Expliquer le principe de cette technique.
Un excès connu d'ions Fe2+ réagit avec les ions nitrates
contenus dans une solution préparée à partir d'un engrais liquide. Les
ions Fe2+ qui n'ont pas réagi sont titrés par une solution
de dichromate de potassium.
Le photomètre de flamme est un appareil qui permet de doser des
solutions d’ions alcalins : la solution d’ions est pulvérisée avec un
mélange d’air et de carburant (propane). La flamme obtenue est colorée
par l’ion à doser : violet pâle pour le potassium. Un filtre
isole la longueur d’onde caractéristique de l’ion étudié. Un dispositif
de mesure ( cellule photoélectrique, amplificateur,
milliampèremètre), donne une valeur proportionnelle au flux lumineux
reçu. Ce dernier est proportionnel à la concentration de la solution
ionique.
Le
potassium est l'élément chimique de numéro atomique Z = 19.
Donner
la structure électronique de l'atome de potassium dans son état
fondamental.
1s2 2s2 2p6 3s2 3p6
4s1.
Localiser
le potassium dans la clasification périodique en justifiant.
La dernière couche lectronique compte un seul électron, donc colonne
n°1, famille des alcalins.
Le niveau 4 est en partie occupé, donc 4ème ligne.
Ecrire
le schéma de Lewis de l'ion nitrate.
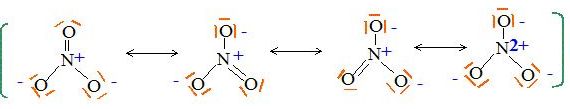
Le
requérant désire connaître la dangerosité des produits chimiques
retrouvés lors de la perquisition. Quelle réponse
pouvez-vous lui apporter ?
Voir le site concernant les risques des produits chimiques :
http://www.inrs.fr/accueil/risques.html
A
chaque proposition attribuer, sans justification, la bonne notion
:
Concerne
la dispersion des résultats mesurés sur un même échantillon, dans le
même laboratoire, mais avec des analystes différents, des appareils
différents, et des jours différents.
|
Réplicabilité
:
|
| Concerne
la dispersion des résultats mesurés sur un même échantillon, dans des
laboratoires différents, avec des analystes différents, des appareils
différents, et des jours différents. |
Reproductibilité
|
Concerne
la proximité ou le rapprochement entre la valeur mesurée et une valeur
de référence considérée comme vraie ou réelle.
|
Justesse.
|
Concerne
la dispersion des résultats mesurés sur un même échantillon, dans le
même laboratoire, avec le même analyste, le même appareil et le même
jour.
|
Répétabilité
|
Concerne
la dispersion des résultats mesurés autour d'une valeur moyenne.
|
Précision.
|
Définir "limite de
détection" et "limite de quantification".
La limite de détection d'une méthode d'analyse est la plus petite
quantité d'une espèce qui peut être détectée mais pas forcément
quantifiée avec précision.
La limite de quantification est la quantité la plus faible d’une espèce
dans un échantillon qui peut être déterminée quantitativement
avec fidélité et exactitude.
|
|