|
|
L'acide
méthanoïque, de formule brute CH2O2,
est le plus simple des acides carboxyliques. Naturellement sécrété par
les fourmis (d'où son nom usuel d'acide formique), il est
industriellement synthétisé à partir du méthanol et du monoxyde de
carbone.
Cet acide est couramment utilisé dans l'industrie (textiles,
galvanoplastie, alimentation animale, formulation de laques, solvants,
produits ménagers …). Son récent mode de synthèse par hydrogénation
catalytique du dioxyde de carbone ouvre une voie intéressante pour le
stockage du dihydrogène et la valorisation du CO2.
A l'inverse, sa décomposition contrôlée s'avère prometteuse pour la
propulsion automobile (moteurs thermiques ou piles à combustible).
Ecrire
la formule semi-développée de l'acide méthanoïque.
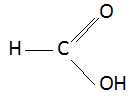
Ecrire
la réaction globale – sans mentionner le catalyseur – de sa synthèse
par hydrogénation catalytique du dioxyde de carbone.
H2 + CO2 --->
HCOOH.
Pour deux solutions aqueuses diluées d'acide méthanoïque, les valeurs
de pH suivantes ont été mesurées :
Concentration initiale (mol.L-1) : 10-2
; pH = 2,91 et 10-3 mol/L, pH = 3,47.
Rappeler
la différence de comportement, en solution aqueuse, d'un acide fort et
d'un acide faible.
Un acide fort est entièrement dissocié dans l'eau. La réaction entre un
acide faible et l'eau est partielle et conduit à un équilibre.
L'acide méthanoïque est un acide faible ; vérifier
ce fait expérimental en calculant, pour les deux concentrations
précédentes, le pH d'une solution d'acide fort.
Pour un acide fort pH = -log C ; -log 10-2 = 2 ;
-log 10-3 = 3.
En diluant 10 fois un acide fort, le pH augmente de une unité, ce qui
n'est pas le cas d'un acide faible.
On réalise le titrage pH-métrique de Va = 50 mL
d'une solution d'acide méthanoïque par une solution de soude à cb
= 0,10 mol.L-1. Pour ce faire, on mesure le pH
de cette solution pour des volumes spécifiques Vb
de soude ajoutés. La courbe de titrage pH = f(Vb)
ainsi que la courbe dérivée d(pH)/d(Vb) = f(Vb)
obtenues sont données ci-après :
|
.
|
Ecrire
l'équation de la réaction du titrage.
HCOOH aq + HO-aq ---> HCOO-aq
+ H2O(l).
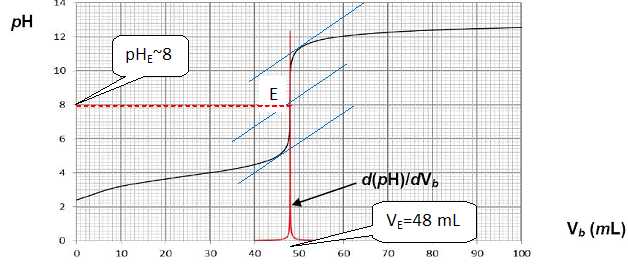
Déterminer,
à partir de la courbe de titrage, le volume de soude versé au point
d'équivalence VE (préciser la
méthode expérimentale utilisée pour ce faire).
A l'équivalence la courbe dérivée présente un maximum ; la méthode des
tangentes permet de déterminer le point équivalent.
Calculer
la concentration molaire ca de la solution d'acide méthanoïque titrée.
A l'équivalence, les réactifs sont en proportions stoechiométriques : CaVa
=CbVE ;
Ca
=CbVE / Va= 0,10 *48 / 50 = 9,6 10-2
mol/L.
Au point
de demi-équivalence, calculer les quantités d'acide méthanoïque n½éq et de sa
base conjuguée n′½éq présentes
dans le récipient du titrage. Comment nomme-t-on la solution présente
dans ce récipient, en ce point du titrage ?
A la demi-équivalence de ce dosage les quantités de matière d'acide
méthanoïque et d'ion méthanoate sont égales.
n½éq = ½CbVE
= 0,5*0,10*48 10-3=2,4 10-3
mol.
A la demi-équivalence, la solution obtenue est une solution tampon.
Donner
l'expression littérale du pH de la solution présente dans le récipient
du titrage au point de demi-équivalence, en fonction des quantités
molaires trouvées.
pH = pKa + log([HCOO-] /
[HCOOH]) = pKa.
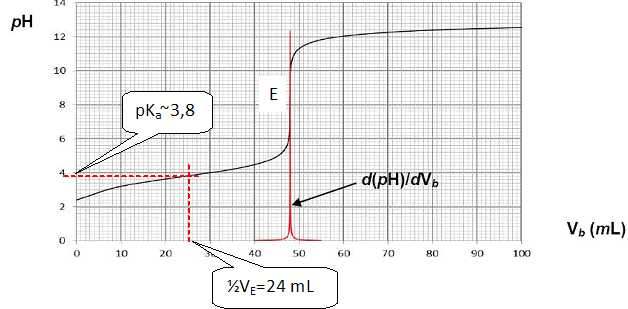
En
déduire, à partir de la courbe de titrage, la valeur du pKa de
l'acide méthanoïque.
|
|
Parmi les
indicateurs colorés ci-dessous, le(s)quel(s) vous semble(nt) le(s) plus
adaptés(s) pour le titrage colorimétrique de l'acide méthanoïque
?
| Indicateur |
Zone
de virage |
Couleur
acide |
Couleur
basique |
| Hélianthine |
3,1 - 4,4 |
rose |
jaune |
| Bleu de
bromothymol |
6,0 - 7,6 |
jaune |
bleue |
| Phénolphtaléine |
8,2 - 10 |
incolore |
violet |
| jaune
d'alizarine |
10,1 -
12,0 |
jaune |
rouge |
Le pH du point équivalent doit
appartenir ou être très proche de la zone de virage de l'indicateu
coloré.
Le bleu de bromothymol et la phénolphtaléine peuvent donc convenir.
|
|