|
|
Réaction
solide-gaz.
Le tétrachlorure d'aluminium UCl4 peut être obtenu à 450°C
par réaction du tétrachlorure de carbone sur l'oxyde d'uranium UO3.
Cette réaction s'accompagne d'un dégagement de dichlore et de dioxyde
de carbone.
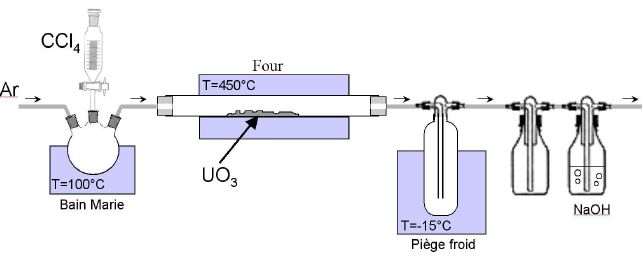
Le schéma du montage est représenté ci-dessous. L'ampoule de coulée
permet d'introduire le tétrachlorure de carbone progressivement dans le
montage. Il est entraîné par un gaz vecteur, l'argon.
L'uranium
naturel est composé de 99,275 % de l'isotope 238U, 0,718%
de l'isotope 235U et 0,0057% de 234U.
Définir
la notion d'isotopie.
Deux isotopes ne diffèrent que par leur nombre de neutrons. Ils ont le
même numéro atomique.
Calculer
la masse atomique molaire de l'uranium naturel.
M(238U) = 238,03 g/mol ; M(235U)
= 235,03 g/mol ; M(234U) = 234,03 g/mol.
0,99275*238,03 + 0,00718*235,03 + 0,000057*234,03 =238,005 ~238,00
g/mol.
Ecrire
la réaction de synthèse en précisant l'état physique des réactifs et
des produits.
CCl4 : Tébullition = 76°C ; UCl4 : Tfusion
=590°C. UO3 se décompose au dessus de
650°C.
2UO3(s) + 3CCl4(g) --> 2UCl4(s) +
2Cl2(g) + 3CO2(g).
Calculer la masse de
tétrachlorure de carbone nécessaire pour convertir 0,02 mol d'UO3
en UCl4, sachant que seulement 30 % du gaz réagit.
n(CCl4) = 1,5 n(UO3) = 0,03 mol.
Tenir compte du rendement : 0,03 / 0,30 = 0,1 mol.
M(CCl4) = 12,01 + 4*35,45 =153,81 g/mol.
Masse de CCl4 : 0,1 * 153,81 = 15,38 ~15 g.
Quelle
est la quantité totale de dichlore produite, en mol et en gramme.
n(Cl2) = n(UO3) = 0,02 mol.
m(Cl2) = 0,02*2*35,45 = 1,418 ~1,4 g.
Quelle est l'utilité
du piège à froid ?
Le piège à froid permet de liquéfier le
tétrachlorure de carbone qui n'a pas réagi.
Comment peut-on
détruire le dichlore non utilisé ?
Le
dichlore est soluble dans une solution de soude : dismutation en ClO-
et Cl- ( eau de Javel). Une solution concentrée de
thiosulfate de sodium va réduire le dichlore résiduel.
Pourquoi
place-t-on un flacon laveur contenant de la soude à la sortie du
montage ? Ecrire les réactions qui s'y produisent.
La soude réagit avec le
dichlore, gaz toxique formé, ainsi qu'avec le dioxyde de
carbone.
2Na+aq
+ 2HO-aq + Cl2(aq) = 2 Na+aq
+ ClO-aq + Cl-aq
+ H2O(l).
CO2(aq) + HO-aq = HCO3-aq.
|
.
|
Séparation
par résine échangeuse d'ions.
L'uranium
des centrales nucléaires est préparé à partir de minerais assez
pauvres. Après broyage, l'uranium est extrait de la poudre par attaque
à l'aide d'une solution d'acide sulfurique en présence d'agents
oxydants. La solution obtenue est un mélange de cation uranyle UO22+aq et de complexes sulfato. Elle contient le plus souvent des ions Zn2+ et Cd2+ qu'il est nécessaire de séparer. L'extraction par des résines échangeuses d'ions est un des moyens de purification.
Un échangeur d'ion est un solide dont la propriété essentielle est de
pouvoir échanger des ions. Une résine échangeuse d'ion est un polymère
tridimensionnel réticulé sur lequel sont greffés des groupements
fonctionnels acido-basiques ionisables.
Indiquer les deux types de groupements fonctionnels les plus couramment rencontrés dans les résines échangeuses :
- de cations :. anion sulfonate -SO3-, carboxylate -CO2-.
- d'anions : cation triméthylammonium -N(CH3)3+.
On identifie sur les produits commerciaux une variable appelée " capacité d'échange".
Indiquer à quelle grandeur "moléculaire" se rattache cette notion et comment peut-on la repérer quantitativement.
La capacité d'échange d'une résine est le nombre de sites actifs où l'échange d'ion peut se produire. Nombre de mole de groupe actifs par kg de résine.
La capacité d'échange peut être déterminée au laboratoire en mesurant
le nombre de millimoles d'ion sodium absorbés par 1 g de résine sèche
sous forme acide.
On considère une résine échangeuse de cations sous sa forme protonnée. Si le groupe fonctionnel n'est pas complexant
indiquer l'ordre d'affinité croissante de la résine pour les cations suivants : Na+, Cs+, Mg2+, Ca2+, Al3+.
Les ions sont d’autant plus retenus que leur charge est plus élevée.
L’affinité des ions pour la résine augmente dans une famille d’éléments avec le numéro atomique.
Na+ < Cs+ < Mg2+ < Ca2+ < Al3+.
On appelle coefficient de partage Pi d'un ion i, le rapport de sa concentration à l'équilibre dans la résine et dans la solution : Pi = Ci(résine) / Ci(solution).
Arésine + Bsolution = Asolution + Brésine.
Exprimer la relation entre les coefficient de partage de deux espèces A et B et la constante de l'équilibre d'échange KA/B, exprimée comme un rapport de concentration.
KA/B = [Asolution][Brésine] / ([Arésine][Bsolution]) =PB / PA.
En déduire que la séparation est d'autant meilleure que les coefficients de partage sont très différents.
Pour une bonne séparation la constante KA/B doit être la plus grande possible : en conséquence PB >> PA.
|
|
On
appelle largeur de la bande éluée le volume, centré autour du volume de
concentration maximum, permettant de recueillir la quasi-totalité (
99,9 %) du composé. La figure ci-dessous représente deux courbes
d'élution d'un même composé pour deux résines différentes :
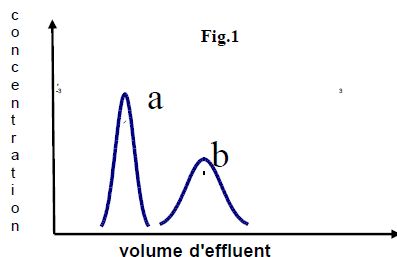
Indiquer, en justifiant brièvement, quelles sont les meilleurs conditions d'élution ?
Un chromatogramme correct est composé de pics de forme
symétrique, pas trop larges et bien séparés.
On joue sur les conditions opératoires afin d'obtenir à un tel chromatogramme.
Les facteurs favorables à une bonne séparation sont des temps
de rétention suffisamment différents (choix de la colonne) et des pics
peu élargis.
Une diminution de la température du four conduit à une
augmentation du temps de rétention.
Une augmentation de la longueur de la colonne augmente également les
temps de rétention mais souvent on observe un élargissement des pics.
On souhaite séparer par
élution des cations d'éléments de transition à l'état bivalents. Pour
ce faire on prépare une colonne, de volume de 8 mL, contenant une
résine anionique sous forme chlorure.
L'échantillon à analyser contient des ions sous forme de chlorocomplexes MCl64- en milieu acide chlorhydrique concentré ( 12 mol/L). Le volume de solution à analyser est 0,8 mL.
Après passage de la solution sur la résine on élue, successivement, par
portions de 6 mL d'acide chlorhydrique : (a) concentré, (b) 6 mol/L,
(c) 4 mol/L, (d) 2,5 mol/L et (e) 0,5 mol/L. On recueille en sortie de
résine le volume élué par fractions de 0,5 mL et l'on analyse sur
chaque fraction les éléments présents dans la solution mère. La courbe
d'élution présente l'allure ci-dessous :
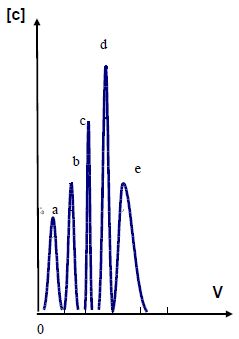
On donne l'ordre de stabilité croissante des complexes chloro de ces ions dans HCl concentré : Ni2+ << Mn2+ < Co2+ <<Cu2+<<Fe2+.
Identifier les différents pics d'élution.
Plus
le complexe est stable, plus l'ion fixé sur la résine aura tendance à
passer ( être élué) en solution acide chlorhydrique concentrée.
(a) correspond à Fe2+ ; (b) à Cu2+ ; (c) à Co2+ ; (d) à Mn2+ ; (e) à Ni2+.
|
|