|
|
L'eau
chaude sanitaire doit être maintenue à 60°C durant son trajet dans les
tuyaux du circuit de distribution. L'élévation de température
favorise le dépôt da tartre dans l'installation. Il est nécessaire de
traiter préventivement l'eau chaude pour éviter l'entartrage si l'eau
distribuée est dure.
Donner la définition d'une eau dure.
La dureté d'une eau est donnée par la
concentration totale en ions calcium et en ions magnésium . On définit le titre
hydrotimétrique (°TH) par : 1° TH = 10-4 mol/L d'ion calcium et magnésium. A partir de 25°TH, l'eau est qualifiée de dure.
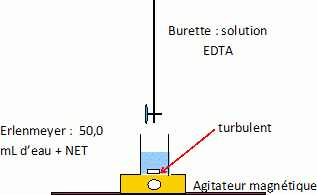
La dureté de l'eau se détermine par un dosage complexométrique par l'EDTA. Le mode opératoire est le suivant :
On place 10 mL d'eau à analyser dans un erlenmeyer de 150 mL.
On y ajoute 10 mL de solution tampon à pH =10 et 12 gouttes d'une
solution d'indicateur coloré. La solution, incolore avant l'ajout
d'indicateur coloré, prend une coloration rose.
On place dans la burette une solution de sel disodique d'acide éthylène-diaminetétracétique dihydraté Na2H2Y, 2H2O de concentration c = 0,005 mol/L.
On appelle v le volume de titrant versé.
On observe le virage de la solution du rose au bleu pour un volume versé v = vE.
Faire un schéma du montage correspondant au titrage ci-dessus.
L'EDTA, noté H4Y est un tétraacide dont les pKa successifs sont respectivement : 2,0 ; 2,7 ; 6,4 et 10,2.
Donner les domaines de prédominance des différentes formes de l'EDTA en fonction du pH.
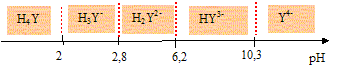
Indiquer l'espèce qui prédomine à pH = 10.
A pH= 10, HY3- prédomine.
|
.
|
Le volume d'EDTA nécessaire pour observer le virage de l'indicateur est vE = 3,0 mL.
En déduire la valeur de [Ca2+] + [Mg2+] dans l'échantillon d'eau à analyser.
Equation bilan support du dosage :
Mg2+ +HY3- =
MgY2–+HO- ;
Ca2+ +HY3- = CaY2–
+HO-.
A l'équivalence, les
quantités de matière de réactifs mis en
présence sont en proportions
stoéchiométriques :
n0(Ca2++Mg2+)
= vE. c = 3,0 10-3 * 0,0050 = 1,5
10-5 mol dans 10 mL d'eau
minérale.
[Ca2+]0+
[Mg2+]0
= 1,5 10-5 /
10-2 = 1,5
10-3
mol/L.
Calculer la dureté de l'eau analysée. 1° TH = 10-4 mol/L d'ion calcium et magnésium.
1,5
10-3 / (1,0 10-4) =15 °TH.
|
|