|
|
Décrire
une ( ou plusieurs) expérience(s) permettant de mettre en évidence la
décomposition et la recomposition de la lumière blanche.
Décomposition :
rétroprojecteur sur lequel on place un carton noir percé d'une fente de
1cm de large et 20 cm de long.
Placer un réseau 600 traits sur la lentille du rétroprojecteur.
Orienter le miroir pour une observation murale.
Un
prisme de verre disperse ( phénomène de dispersion) la lumière blanche.
A la sortie du prisme on observe un arc en ciel, le bleu étant plus
dévié que le rouge.
Recomposition
: la
vision humaine utilise trois capteurs rouge, vert et bleu (RVB)
capables de réaliser la synthèse de toutes les autres couleurs.
Mettre un disque de Newton en rotation rapide. Les
couleurs du disque « se mélangent » pour donner du blanc, on dit
qu’elles se recomposent.
Proposer une
définition de la longueur d'onde.
La longueur d'onde est la distance parcourue par l'onde à la célérité c
pendant une période temporelle.
Expliquer
les notions suivantes :
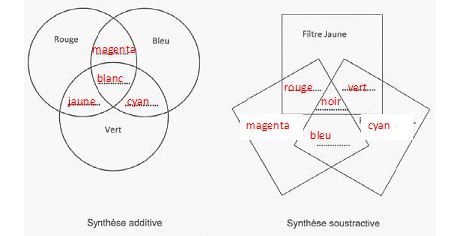
Synthèse additive des couleurs
: les trois couleurs primaires sont le bleu, le vert et
le rouge. En
synthèse additive on combine plusieurs couleurs primaires afin
d'obtenir une nouvelle couleur.
L'addition des trois couleurs primairesdonne du blanc ; l'absence de couleur donne le noir.
L'addition de deux couleurs primaires conduit aux couleurs secondaires
: rouge + vert donnent le jaune ; rouge + bleu donnent le magenta ;
bleu + vert donnent le cyan.
Synthèse
soustractive des couleurs : la synthèse soustractive
est l'absorption de lumières colorées.
Les couleurs primaires de cette synthèse sont le cyan, magenta et le
jaune. Deux couleurs sont dites complémentaires si leur superposition
donne du noir.
Une peinture doit être
éclairée pour être observée.
Les
pigments utilisés en peinture absorbent certaines teintes et diffusent
d'autres teintes ; on parle de synthèse soustractive.
Compléter
les deux schémas suivants.
l'exercice suivant est proposé à la classe :
Un architecte souhaite aménager une pièce éclairée par une lumière dont
la couleur peut changer. Il dispose de DEL de couleur verte, bleue et
rouge.
Indiquer la couleur
obtenue par superposition des faisceaux des trois DEL.
En synthèse additive, la superposition des trois couleurs primaires
donne le blanc.
Lorsqu'elle est éclairée à la lumière blanche, la pièce possède un mur
peint en rouge. Indiquer
la couleur si ce mur est éclairé par :
Un faisceau de couleur bleue. Ce mur absorbant le vert et le bleu,
paraît noir.
Un faisceau de couleur rouge : ce mur diffuse le rouge.
Un faisceau de couleur jaune : le jaune est un mélange de vert et de
rouge. Le vert étant absorbé, le mur paraît rouge.
Un faisceau de couleur cyan : le cyan est un mélange de vert et de
bleu, couleurs absorbées par le mur ; ce dernier paraît noir.
Cet exercice met évalue la capacité " réaliser une synthèse
additive des couleurs" et les connaissances " savoir que 3
lumières monochromatiques suffisent pour créer toutes les couleurs".
|
.
|
Production d'eau chaude sanitaire.
Energie de liaisons données à 25°C pour des composés gazeux en kJ/mol.
DC-H =410 ; DC-C =348 ; DC=C =612 ; DO-H =460 ; DO=O =494 ; CC=O =795 dans CO2.
On utilise une chaudière à gaz alimentée soit par du gaz naturel soit
par du butane. On souhaite par cette étude déterminer lequel de ces
deux gaz est le meilleur combustible d'un point de vue écologique et
économique.
Le gaz naturel est constitué essentiellement de méthane CH4.
Indiquer pourquoi ce gaz est dit " naturel".
Le gaz naturel provient de la transformation naturelle, pendant des millions d'années, de matières organiques.
Préciser le nom de la famille d'hydrocarbure à laquelle appartient le méthane.
Hydrocarbures saturés ou alcanes.
L'équation chimique de la combustion complète du méthane est : CH4(g ) + 2O2(g) --> 2H2O(g) + CO2(g).
On considère que les réactifs et les produits sont gazeux et que l'état
final et l'état initial sont à la même température 25°C et à la même
pression P = 1 bar.
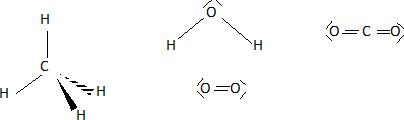
Donner la représentation de Lewis des molécules de méthane, d'eau, de dioxygène et de dioxyde de carbone.
Définir les mots combustible, comburant, combustion.
Une combustion est une réaction exothermique d'oxydoréduction.
Un combustible est uns substance capable de brûler en présence d'un autre réactif, le comburant, en libérant de l'énergie.
Un comburant est une matière riche en oxygène susceptible d'entretenir une combustion.
Décrire un protocole permettant de mettre en évidence les produits lors d'une combustion.
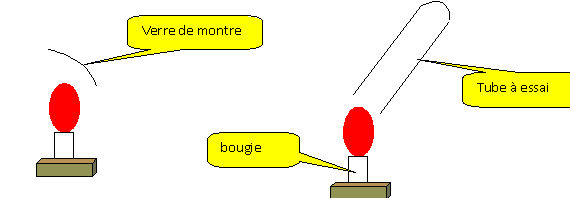
La partie froide du verre de montre
se couvre de buée : la combustion de la bougie
produit de l'eau.
Recueillir les gaz issus de la
combustion de la bougie dans un tube à essais.
Ajouter dans ce tube 2 mL d'eau de chaux. Boucher et
agiter. L'eau de chaux se trouble : la
combustion de la bougie produit du dioxyde de
carbone.
Calculer l'énergie libérée lors de la combustion complète dans le dioxygène d'une mole de méthane.
Liaisons rompues : 4 liaisons C-H et 2 liaisons O=O. Liaisons créées : 4 liaisons O-H et 2 liaisons C=O.
E = 4 DC-H +2DO=O -4DO-H-2DC=O =4*410+2*494-4*460-2*795= -802 kJ/mol.
Lorsque la combustion se fait avec un défaut de dioxygène, il apparaît un nouveau composé gazeux. Donner son nom, sa formule chimique. Indiquer 3 adjectifs permettant de caractiriser ce gaz.
Le monoxyde de carbone CO est un gaz incolore, inodore, toxique pour les mamifères.
Lorsque le défaut d'air est important, il apparaît des suies.
Indiquer l'élément chimique correspondant à ses suies. Donner son symbole chimique.
L'élément carbone C.
|
|
Etude de combustion complète du butane.
Ecrire l'équation chimique de la combustion complète du butane.
C4H10(g ) + 6,5O2(g) --> 5H2O(g) + 4CO2(g).
L'énergie de la combustion complète du butane est -2,61 103 kJ/mol.
Donner la signification du signe négatif.
La réaction exothermique libère de l'énergie dans le milieu extérieur.
Une famille consomme chaque jour en moyenne 300 L d'eau chaude
sanitaire. Pour augmenter de 1°C la température de 1 kg d'eau, il faut
fournir, quelle que soit la température initiale 4,18 kJ.
Déterminer l'énergie nécessaire pour chauffer 300 L d'eau de 15°C à 60 °C.
Q = m c Dt = 300 *4,18*(60-15) =5,643 104 ~5,6 104 kJ.
Déterminer
la quantité de dioxyde de carbone produite chaque jour si la chaudière
fonctionne au méthane si on suppose la combustion complète.
Quantité de matière de méthane : 5,643 104 / 802 =70,36 mol ; n(CO2) = n(méthane) = 70,36 ~70 mol ou 70,36*44 =3096 ~3,1 kg.
Même question pour le butane.
Quantité de matière de butane : 5,643 104 / (2,61 103) =21,62 mol ; n(CO2) = 4 n(butane) = 4*21,62 = 86,18~86 mol ou 86,486*44 =3,805 kg ~3,8 kg.
Indiquer quelles sont les conséquences d'une augmentation de la teneur en CO2 de l'atmosphère.
Le dioxyde de carbone est l'un des gaz à effet de serre : il contribue
à l'augmentation de la température moyenne de l'atmosphère.
Les océans s'acidifient en absorbant une partie de ce dioxyde de carbone.
Calcul du coût.
GDF facture le gaz naturel au prix de 0,0040€ par kWh consommé. Le
coùut moyen de l'énergie dépensée chaque jour pour la production d'eau
chaude sanitaire lorque la chaudière fonctionne au méthane est 0,620 €.
Le butane est commercialisé en bouteilles de 13 kg au prix de 26,00 € l'unité.
Calculer
le coût de l'énergie dépensée chaque jour pour la production d'eau
chaude sanitaire lorsque la chaudière fonctionne au butane.
Masse de butane : n(butane) M(butane) = 21,62 *58 =1254 g ~1,25 kg ; coût : 1,254*26/13 =2,51 €.
Lequel de ces deux combustibles apparaît le meilleur d'un ponit de vue écologique et économique ?
Le méthane est plus économique que le butane.
Le méthane est également plus écologique : chaque jour, pour une énergie produite identique, la masse de CO2 produite est plus faible qu'avec le butane.
|
|