|
|
Il
existe deux grands types de colle : les colles thermoplastiques et les
colles thermodurcissables.
Donner
une définition des termes thermoplastique et thermodurcissable.
Thermoplastique : matière qui se ramollit d'une façon répétée lorsqu'elle
est chauffée au-dessus d'une certaine température, mais qui, au-dessous,
redevient dure. Une telle matière conservera de manière réversible sa
thermoplasticité initiale.
Thermodurcissable : il ne peut être mis en œuvre qu'une seule fois et
devient infusible et insoluble après polymérisation. Une fois durci, sa forme ne
peut plus être modifiée ; ils ont une structure tri dimensionnelle.
Décrire la
principale différence entre ces deux types de colle.
Les
colles thermoplastiques ( réversibles) peuvent redevenir plastiques par
chauffage et présente une tenue médiocre aux intempéries.
Les colles thermodurcissables ( irréverssibles ) permettent le collage
à froid ou à chaud, présentent une excellente tenue aux intempéries, au
feu et un bon vieillissement.
La rapidité de prise d'une colle dépend de plusieurs paramètres,
notamment de la qualité du durcisseur employé. En effet le degré de
polymérisation de la colle dépend de ce durcisseur. Par exemple pour
les colles de type " urée-formol" ( famille des thermodurcissables), la
vitesse de prise est extrêmement sensible aux variations de pH, la
vitesse augmentant très rapidement avec la diminution du pH.
En général, les durcisseurs sont des substances qui se décomposent en
acide. Ainsi le chlorure d'ammonium libère de l'acide chlorhydrique
avec formation d'eau et d'hexaméthylènetétramine selon la réaction :
....NH4Cl +....CH2O
---> ...(H+ + Cl-)
+ ...(CH2)6N4
+ ...H2O.
Equilibrer
l'équation bilan ci-dessus.
4NH4Cl +6CH2O
---> 4(H+ + Cl-)
+ (CH2)6N4
+ 6H2O.
La courbe ci-dessous repprésente l'évolution de la concentration en ion
H3O+ au cours du temps.
Cette évolution influe directement sur le pH de la solution donc sur la
vitesse de prise de la colle. La réaction a été réalisée à 20°C. Le
volume réactionnel est supposé constant lors de la réaction.
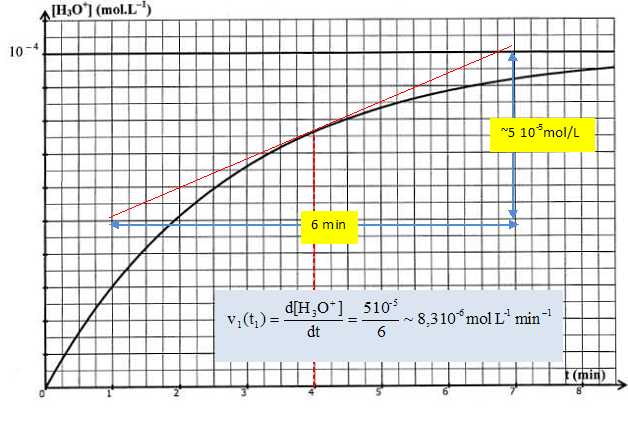
Déterminer
graphiquement la valeur numérique de la vitesse volumique v1(t1)de
formation des ions H3O+
à t1 = 4 min
|
.
|
Un
des facteurs caractérisant la cinétique d'une réaction chimique est le
temps de demi-réaction t½. On supposera que la
concentration en ion oxonium H3O+
est initialement négligeable.
Définir
le temps de demi-réaction.
Le
temps de demi-réaction est la durée au bout de laquelle l'avancement
est égal à la moitié de l'avancement final.
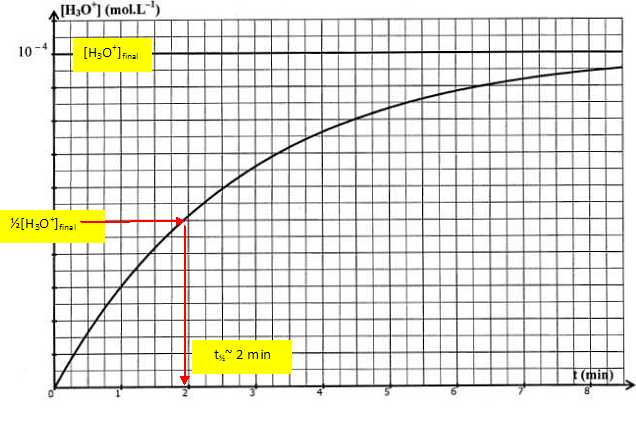
Déterminer
graphiquement t½.
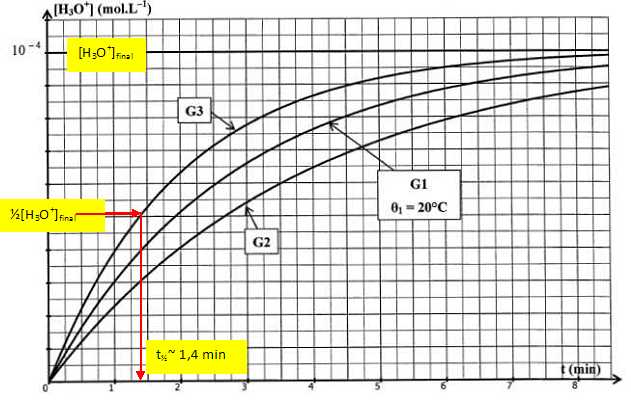
Sur le
graphique ci-dessous, on représente l'évolution de la même réaction
réalisée à trois températures différentes q1
=20°C, q2
et q3.
Les concentrations des réactifs restent inchangées.
Quelle
courbe G2 ou G3 correspond à la réaction réalisée à une température
supérieure à 20°C ? Justifier.
G3 : la température est un facteur cinétique : à
une température supérieure à 20 °C, correspond un temps de
demi-réaction plus petit ( inférieur à 2 min ).
|
|
Modélisation
de la cinétique de réaction.
L'évolution de la concentration en ion H3O+
au cours du temps peut se modéliser par une relation du type [H3O+](t)
= A(1-exp(-kt)). Dans cette expression A et k sont des constantes et le
temps est exprimé en minute. La concentration en ion oxonium est
exprimée en mol/L.
Que
représente A et quelle est son unité ?
[H3O+](t--->
infini) = A ~10-4 mol/L, concentration finale en
ion oxonium.
Quelle
est l'unité de k ?
kt est sans dimension ; t s'exprime en minute ; k s'exprime en minute-1.
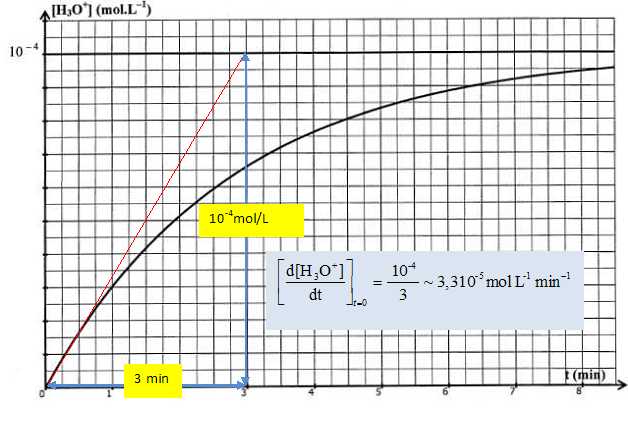
Déterminer
graphiquement la valeur de k.
[d[H3O+](t) /dt ] t=0=Ak
; k = [d[H3O+](t)
/dt ] t=0/A =3,3 10-5 /
10-4 =0,33 min-1.
D'après
les graphiques, la température influence-t-elle la constante A ?
Justifier.
A est indépendant de la température : les courbes tendent toutes vers
la même valeur A = 10-4 mol/L quelle que soit la
température.
D'après
les graphiques, la température influence-t-elle la constante k ?
Justifier.
k dépend de la température, [d[H3O+](t)
/dt ] t=0 augmente avec la
température.
A
partir de la valeur de la constante k, retrouver la valeur du temps de
demi-réaction.
[H3O+](t=t½)
=½A = A(1-exp(-kt½)).
½ =exp(-kt½) ; ln2 = kt½
; t½ = ln2/k = ln2 / 0,33 ~ 2 min.
|
|