|
|
Quinine et
chloroquine. Extraction de
la quinine.
L'écorce de quinquina utilisée dans la cordilière des Andes comme
antipyrétique a été apportée en Europe au début du XVIIe
siècle. En 1820, P Pelletier et J Caventou ont extrait la quinine,
représentée ci-dessous.
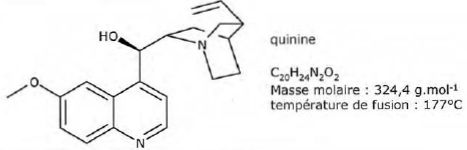
La quinine a été le premier médicament efficace contre le paludisme.
Que
signifie le terme "antipyrétique" ?
Les
antipyrétiques sont des médicaments destinés à abaisser la
température du corps ou à diminuer la fièvre.
La quinine est une dibase notée Q dont les couples acido-basiques sont
: QH22+/QH+ ( pKa = 5,1) et
QH+ /Q ( pKa2=9,7).
Identifier sur la
structure les groupes caractéristiques responsables de ces propriétés
acido-basiques. On ne demande pas d'attribuer leur pKa.
Ces propriétés acido-basiques sont dues aux doublets non liants portés
par les atomes d'azote engagés dans les cycles. Ces cycles n'étant pas
aromatiques, ces doublets sont assez disponibles.
On propose quelques étapes du protocole d'extraction de la quinine à
partir de l'écorce de quiquina. ( extrait du BUP mars 2009, vol
103, n°912, p311-320 ).
L'écorce est tout d'abord traitée par de la soude dans l'éthanol, puis
extraite au dichlorométhane. La solution limpide extraite est alors
soumise au protocole de purification suivant :
- Prélever 50 mL de la solution de dichlorométhane résultant de
l'extraction
- Etape 1 : extraire
la solution de dichlorométhane à l'aide de 2 fois 10 mL de solution
d'acide chlorhydrique de concentration environ 0,1 mol/L. Réunir les
deux phases aqueuses, les laver à l'aide de 10 mL de dichlorométhane.
Etape 2 :
dans un erlenmeyer, ajouter goutte à goutte une solution de soude de
concentration environ 0,5 mol/L ( vérifier le pH à l'aide de papier pH
). L'ajout de soude provoque un précipité blanc dans l'erlenmeyer.
Etape 3 :
une fois que le pH est de 12, extraire cette phase aqueuse à l'aide de
deux fois 20 mL de dichlorométhane.
Etape 4 :
réunir les phases organiques, ajouter une spatule de sulfate de sodium
anhydre, filtrer à l'aide d'un papier filtre plissé. Transvaser le
filtrat dans un ballon taré et évaporer le solvant.
Analyser
soigneusement le protocole afin d'expliquer en quoi les étapes 1 à 3
permettent disoler la quinine.
L'extraction double
est plus efficace que l'extraction simple à volume de solvant identique.
Etape 1
: dans le dichlorométhane, phase organique, la quinine se trouve sous
la forme "Q". Lors de l'ajout d'acide chlorhydrique, la quinine se
trouve sous la forme QH2+, soluble dans un solvant
polaire comme l'eau, quasiment insoluble dans le dichlorométhane.
Etapes 2 et 3 : l'ajout de soude
jusqu'à pH= 12 fait passer la quinine sous la forme Q, quasiment
insoluble dans l'eau. La quinine précipite. La forme Q de la quinine
étant très soluble dans le dichlorométhane, on peut l'extraire grâce à
se solvant.
Identifier
les objectifs de l'étape 4.
Eliminer les traces d'eau grâce au sulfate de sodium anhydre, solide
éliminer ensuite par filtration.
Evaporer le solvant volatil afin de récupérer la quinine.
|
.
|
Synthèse de la chloroquine.
La chloroquine H est un antipaludéen de synthèse, mise sur le marché en
1949. Il présente moins d'effets secondairesque la quinine qui peut
provoquer hypoglycémie, hypotension, vertiges, troubles allergiques...
Sa structure est indiquée ci-dessous.
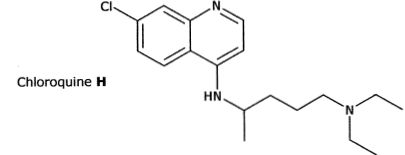
Une synthèse de la
chloroquine à partir de la 2-chloroaniline a été publiée en 1946 ( J.
Am. Chem Soc. 1946, 68, 113-116 ). Les étapes de la synthèse sont
schématisées ci-dessous.
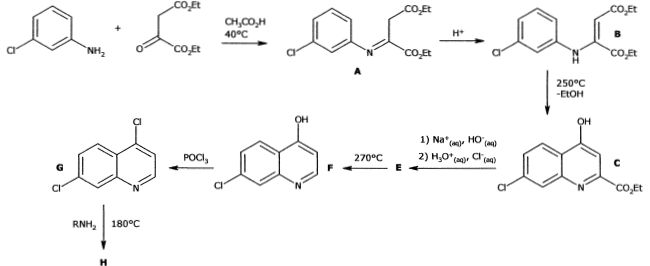
Préparation de l'imine A.
Les différentes étapes d'un mécanisme de la synthèse d'une imine catalysée par les ions H+ sont reproduits.
Compléter le mécanisme.
Indiquer les charges formelles manquantes sur les intermédiaires
réactionnels, les doublets d'électrons impliqués et les flèches
indiquant leurs déplacements.
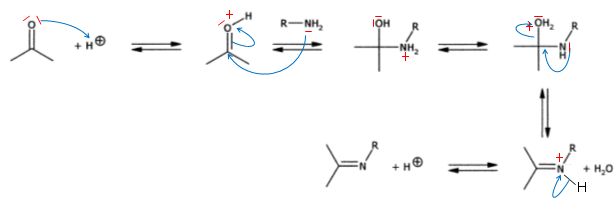
Pourquoi la formation d'une imine est-elle ralentie si le pH est trop faible ?
La
première étape du mécanisme ci-dessus ( protonation de l'oxygène du
carbonyle ) n'a pas lieu. Le carbone du carbonyle est moins activé en
vue d'une attaque par le doublet de l'azote.
Proposer un mécanisme pour la réaction, catalysée par les ions H+, pour passer de l'imine A au composé B.
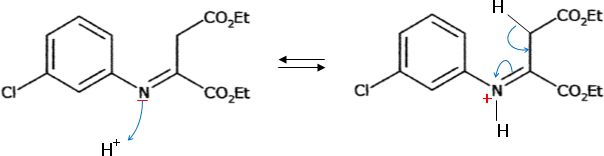
Etape B--> C.
Reproduire la molécule B en indiquant les atomes qui se lient au cours de la transformation B---> C.
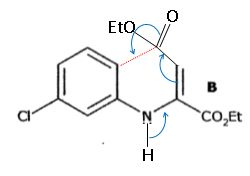
C est en équilibre avec la molécule C' : 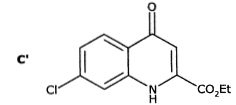
De quel type d'équilibre s'agit-il ? Justifier par un argument structural que C est largement majoritaire.
Il s'agit d'un équilibre
céto-énolique. Dans la molécule C, les deux doubles liaisons C=C du
cycle azoté sont conjuguées avec les 3 doubles liaisons du cycle
aromatique. C est stabilisée par résonance.
La transformation conduit également à un composé D, un isomère de C. Représenter D.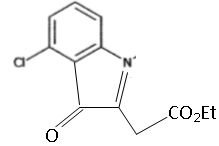
L'isomère C est séparé de l'isomère D par recristallisation dans l'acide acétique glacial.
Que signification le qualiquatif " glacial " dans ce contexte ?
L'acide acétique pur est également nommé acide acétique glacial.
Expliquer le principe de la purification par recristallisation.
Le solide à
purifier est dissout dans un solvant ou dans un mélange de plusieurs
solvants chaud ; puis on refroidit la solution pour provoquer la cristallisation
du solide que l’on isole par filtration. Quant aux impuretés, elles doivent
êtres solubles dans le solvant à chaud comme à froid.
|
|
Etape C--> E.
Quel est le nom de la réaction mise en oeuvre lors du traitement de C par une solution aqueuse d'hydroxyde de sodium ?
Saponification ou hydrolyse basique d'un ester suivi du passage à l'acide carboxylique en ajoutant de l'acide chlorhydrique.
Donner le mécanisme de cette réaction. On pourra utiliser une représentation simplifiée de C.
Dans le cas général d'un ester :
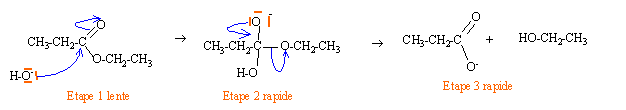
Représenter le produit E obtenu.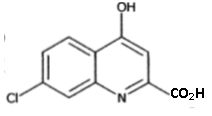
Etape E--> F.
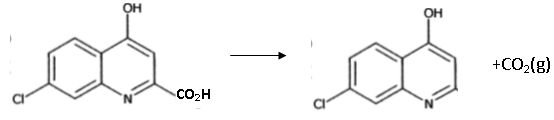
Le composé F est obtenu par simple chauffage de E dans une huile minérale.
Donner l'équation de la réaction modélisant le passage de E à F. Comment s'appelle cette réaction ? Décarboxylation d'un acide carboxylique.
|
|