|
|
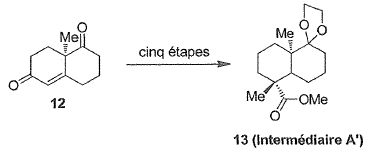
La cétone 12 est obtenue par une réaction de Hajos-Parrish en utilisant
la (R)-proline.
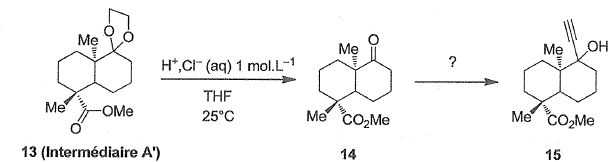
A une solution d'intermédiaire A' (13) dans le tétrahydrofurane ( THF),
une solution aqueuse d'acide chlorhydrique à 1 mol/L est ajoutée
goutte-à-goutte à 25°C sous agitation. L'évolution de la transformation
est suivie par chromatographie sur couche mince ( CCM) ce qui permet de
l'arrêter dès que le substrat 13 a entièrement disparu. Après
traitement,le composé 14 est obtenu. Ce dernier est ensuite transformé
en composé 15.
Pourquoi
est-il préférable d'ajouter l'acide chlorhydrique goutte à goutte et de
stopper la réaction dès que le composé 13 a entièrement disparu ? Quel
élément de verrerie permet cet ajout progressif ?
Une ampoule de coulée permet l'ajout progressif de l'acide
chlorhydrique afin de déprotéger la cétone, sans hydrolyser l'ester.
Sur cet exemple,
décrire succinctement le principe du suivi d'une transformation
chimique par CCM.
A
intervalle de temps régulier, déposer sur une plaque CCM à l'aide d'une
micropipette, le composé 13 ( servant d'étalon ) et une goutte du
milieu réactionnel. Après révélation, on cherche à identifier le
composé 13 dans le milieu réactionnel.
Comment obtenir le
composé 15 à partir du composé 14 ?
L'action d'un organomagnésien acéthylénique sur la cétone donne un
alcool tertiaire.
Le milieu doit être parfaitement anhydre et le solvant utilisé est par
exemple l'éther éthylique.
Les magnésiens acéthylèniques ne sont pas
préparés directement, mais par action d'un alcyne vrai sur un
organomagésien.
Le composé 15 est alors hydrogéné à l'aide d'un catalyseur empoisonné
de Lindlar pour conduire au composé 16. Une solution du composé 16 est
ensuite traitée successivement par le trichlorure de phosphore PCl3
puis par la pyridine pour conduire au diène 17 de formule brute C16H24O2.
Donner
la structure du composé 16.
Hydrogénation de l'alcyne en alcène.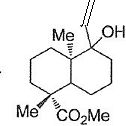
Le passage du composé 16 au diène 17 est globalement une déshydratation.
Montrer
comment les conditions expérimentales permettent effectivement de
réaliser cette transformation.
L’action de PCl3
sur
l'alcool conduit
à la formation d'un dérivé chloré et à HCl ; ce dernier est neutralisé
par la pyridine, une base. En milieu basique, le dérivé chloré peut
subir une réaction d'élimination qui conduit à un alcène. .
Quelles sont les
conditions usuelles de déshydratation d'un alcool ? Pourquoi ces
conditions ne sont-elles pas applicables ici ?
L'élimination d'eau peut être effectuée en présence d'un acide fort
comme H3PO4.
Avec
un alcool tertiaire un léger chauffage en présence d'acide dilué est
suffisante. Les conditions seront plus dures pour un alcool prilmaire (
acide concentré vers 180°C ). Dans ce cas, en milieu acide, l'ester
sera hydrolysé.
|
.
L'action de la méthacroléine 18 sur le diène 17
conduit quantitativement au composé 19.
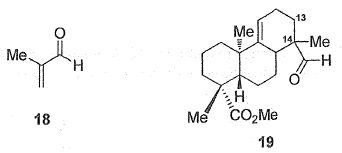
Quel est le nom de
la réaction du passage de 17 à 19 ?
Réaction de Diels-Alder.
La
régiosélectivité de cette réaction n'est pas satisfaisante puisque les
substituants du cycle III sont positionnés sur l'atome de carbone 14 au
lieu du 13. On cherche à interpréter cette régiosélectivité : on donne
ci-dessous les énergies et les formes des orbitales moléculaires (OM)
frontières du composé 17 modélisé par le (E)-3-méthylpenta-1,3-diène et
de la macroléine ( composé 18) calculées par la méthode de Hückel
simple.
HO : orbitale la plus haute occupée ; BV : orbitale la plus basse
vacante ; Ci ou Oi coefficient de l'orbitale
atomique relative à l'atome Ci ou Oi.

|
OM
|
énergie
|
C1
|
C2 |
C3 |
C4 |
C5 |
C6 |
HO
|
a+0,45 ß
|
0,55
|
0,24
|
-0,44
|
-0,58
|
0,26
|
0,20
|
BV
|
a-0,70 ß |
0,60
|
-0,42
|
-0,30
|
0,58
|
-0,15
|
0,08
|
 |
OM
|
énergie
|
O1
|
C2
|
C3 |
C4 |
C5 |
|
HO
|
a+0,86 ß |
0,47
|
-0,07
|
-0,53
|
-0,62
|
0,33
|
BV
|
a-0,36ß |
0,44
|
-0,60
|
-0,23
|
0,63
|
0,07
|
Identifier les OM
permettant l'interaction orbitalaire la plus favorable entre les deux
réactifs ? Justifier.
Il faut que les niveaux des orbitales
frontières de
A et B soient le plus proche possible.
Faisons le calcul de la
différence des niveaux d'énergie :
DE = BV(diène B)
-HO(A) =a-0,70 ß -(a +0,86 ß )= -1,56 ß.
DE = BV(A) -HO(B) =a-0,36 ß -( a+0,45 ß) =
-0,81 ß.
Il y a donc interaction entre
la BV de A et la HO du diène B.
Prévoir
le produit majoritairement obtenu dans l'hypothèse d'un contrôle
orbitalaire.
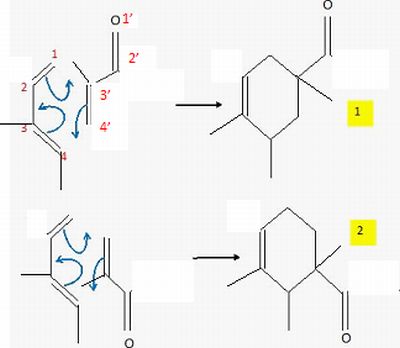
L'une des liaisons se forme
avant l'autre et détermine donc le sens de
la cycloaddition. La liaison qui se forme le plus facilement est celle
reliant les atomes ayant les plus grands coefficients des orbitales
frontières. Le composé obtenu
majoritairement est donc l'isomère 2.
Cette
modélisation permet de rendre compte de la
régiosélectivité observée lors de la réaction de passage de 17 à 19.
Le
groupe de E.A. Theodoraks a alors dû modifier sa stratégie de synthèse
afin d'obtenir la régiosélectivité requise pour obtenir ultérieurement
l'acide acanthoïque. Le début de cette nouvelle voie, non décrite ici,
a permis d'obtenir l'alcool 20, en sept étapes, à partir du composé 15
obtenu précédemment. L'alcool 20 est ensuite transformé en aldehyde 21.
Ce dernier est alors traité par l'ylure de phosphore H2C=PPH3
dans le THF pour donner le composé 22 de formule brute C21H32O2.
Le composé 22 est enfin transformé en acide acanthoïque dans une
dernière étape.
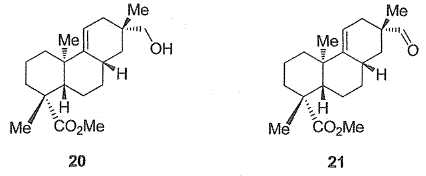
Proposer un réactif
permettant le passage de l'alcool 20 à l'aldehyde 21. De quel type de
réaction s'agit-il ?
L'oxydation douce
de l'alcool primaire à l'aldehyde peut être réalisée en utilisant le
complexe CrO3/pyridine.
Donner la structure
du composé 22 Quel est le nom de la réaction du passage de 21 à 22 ?
La
réaction de Wittig (
l'addition d'un ylure de phosphore sur un
composé carbonylé ) donne un
composé éthylénique.
Proposer une
synthèse en plusieurs étapes de l'ylure de phosphore à partir de
iodométhane et de composés de votre choix.
Préparation de la triphénylphosphine : 3Ph-MgCl + PCl3
---> PPh3 + 3MgCl2.
Substitution nucléophile de la triphénylphosphine sur un dérivé
halogéné dans l'acétone.
PPh3
+CH3I --->Ph3 P+--CH3 + I-.
Ph3 P+--CH3
+ nBuLi ---> Ph3 P+--CH2- + BuH. (
solvant THF ).
[ Ph3 P+--CH2- <---> [Ph3 P=CH2 ].
Proposer une méthode
pour passer du composé 22 à l'acide (-)-acanthoïque.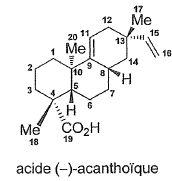
Hydrolyse basique ( saponification ) de l'ester méthylique suivi de
l'ajout d'acide pour passer de l'ion carboxylate à l'acide carboxylique.
|
|









