|
|
Les symboles Me, Et et Ph désignent respectivement les groupes méthyle, éthyle et phényle.
Les acides a-aminés peuvent être utilisés comme inducteurs asymétriques pour accélérer les transformations chimiques.
Les avantages de ce procédé sont nombreux : les conditions
réactionnelles ne sont généralement pas sensibles à l'humidité et à
l'oxygène, les acides aminés sont facilement accessibles, de faible
coût et non toxiques. Ces avantages confèrent à ce type de réactions un
bénifice immense par rapport à la catalyse avec les complexes des
métaux de transition pour la synthèse de composés d'intérêt médical.
Nous allons traiter un exemple de réaction de ce type utilisant la proline comme catalyseur asymétrique.
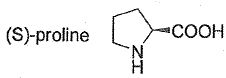
La
réaction de Hajos-Parrish décrite sur la figure ci-dessous est une
réaction énantiosélective de cyclisation d'une trione telle que 3,
catalysée par la prolyne. le substrat trione 3 est lui même obtenu par
addition d'une énone 1 et d'une 1,3-dione 2. Dans les conditions
réactionnelles utilisées, le composé 4 formé n'est pas stable et donne
le composé 5.
On ne cherche pas à interpréter la stéréochimie de cette réaction.
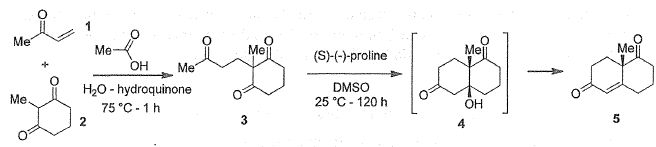
Proposer un mécanisme en milieu basique pour le passage de 3 à 4. Comment cette réaction est-elle communément appelée ?
Cétolisation intramoléculaire.
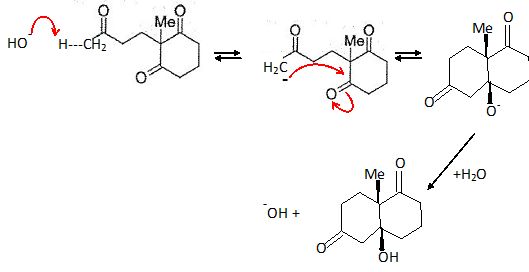
Proposer un mécanisme en milieu basique pour le passage de 4 à 5. Comment cette réaction est-elle communément appelée ?
Réaction d'élimination en milieu basique. ( déshydratation du cétol )
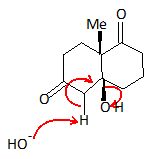
Qu'obtiendrait-on à l'issue de la séquence réactionnelle si la (S)-proline était remplacée par la diéthylamine ? La réaction n'aurait pas été stéréosélective. On aurait obtenu un mélange récémique.
|
.
Structure de l'acide (-)-acanthoïque.
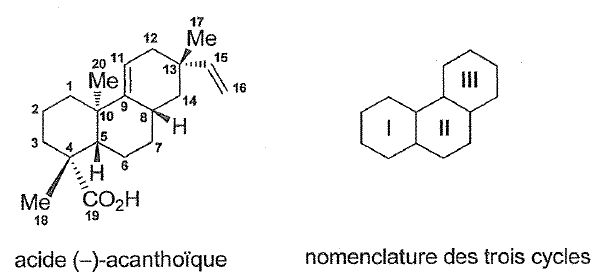
L'étape clé de la synthèse de cet acide est
l'utilisation de la réaction de Hajos-Parrish pour former les cycles I
et I. La proline utilisée lors de cette réaction est le seul indicateur
chiral de la synthèse.
Que signifie (-) dans l'écriture acide (-)-acanthoïque ? Préciser la propriété physique associée.
Une molécule lévogyre est l'un des deux énantiomères d'une même molécule chirale, l'autre forme étant la dextrogyre.
Par convention, une molécule lévogyre est notée (–), et une molécule dextrogyre est notée (+).
Elle a la propriété de faire dévier vers la gauche le plan de polarisation de la lumière polarisée.
Combien de stéréoisomères de configuration existe-t-il de l'acide (-)-acanthoïque ?
Il existe 5 centres chiraux ( carbone n° 4, 5, 8, 10, 13) mais du fait de la rigidité du système il n'existe que 4 énantiomères.
Aucune liaison double ne conduit à l'isomérie ( Z E).
Expliquer
clairement, la méthode adoptée pour déterminer le descripteur
stéréochimique ( ou configuration absolue ) d'un atome asymétrique.
Appliquer cette méthode au carbone n°4.
Numéroter de façon décroissante chacun des quatre substituants selon son
numéro atomique.
CO2H (1) ; carbone n°5 (2) ; carbone n° 3 (3) ; CH3 (4).
On place alors l'atome (ou le groupement) de numéro le plus élevé
derrière.
On regarde dans quel sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3.
- Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le
carbone est Rectus (R),
- Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le
carbone est Sinister (S).
Synthèse de l'intermédiaire A.
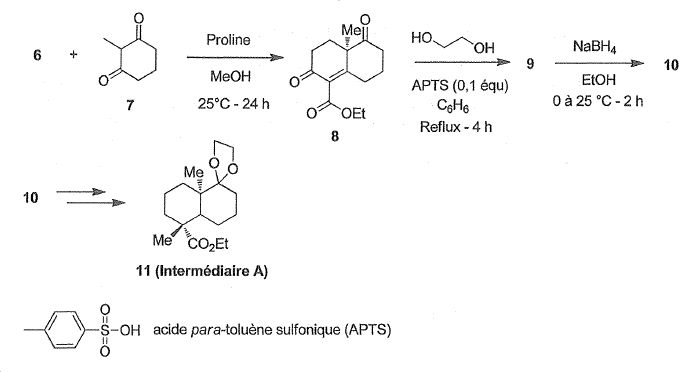
L'obtention de l'intermédiaire A débute par la synthèse du composé 8 à
partir d'une énone 6 et de la dicétone 7 par une réaction de
Hajos-Parrish.
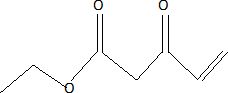
Donner la structure de l'énone 6.
Dans une deuxième étape, une solution du composé 8, d'éthane-1,2-diol
en excès et de 0,1 équivalent d'acide para-toluène sulfonique ( APTS)
dans le benzène est chauffé à reflux pendant 4 h dans un ballon équipé
d'un Dean-Stark pour conduire au composé 9 de formule brute C16H22O5.
Le produit 9 présente les caractéristiques spectroscopiques suivantes :
Nombres d'onde de deux des bandes d'absorption en spectroscopie infrarouge : 1728 et 1674 cm-1.
Caractéristiques des signaux obtenus en RMN du proton :
Signal
|
Déplacement /ppm
|
multiplicité
|
couplage
|
intégration
|
Sa
|
4,23
|
quadruplet
|
J = 6,9 Hz
|
2 H
|
| Sb |
3,98 - 3,89
|
multiplet
|
|
4 H
|
| Sc |
2,46 - 2,41
|
multiplet
|
|
2 H
|
| Sd |
2,33 - 1,61
|
deux multiplets
|
|
8 H
|
| Se |
1,34
|
singulet
|
|
3 H
|
| Sf |
1,25
|
triplet
|
J = 6,9 Hz
|
3 H
|
Représenter le composé 9 et justifier la régiosélectivité de la réaction de passage de 8 à 9.
Protection
d'un groupe carbonyle sous forme d'acétal cyclique. L'autre groupe
carbonyle est conjugué avec la double liaison C=C et le groupe C=O de
la fonction acide carboxylique.
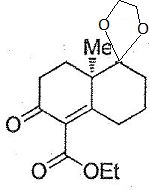
Attribuer les deux bandes extraites du spectre IR.
1728 cm-1 : v C=O du groupe ester ; 1674 cm-1 : v C=O de la cétone conjuguée.
Attribuer les signaux du spectre RMN du proton.
Sa : -O-CH2-CH3 ; Sf : -O-CH2-CH3 ; Se : CH3 (n° 20).
Sb : -O-CH2-CH2-O- protection cétone ; Sc : CH2 (n° 2). Sd : CH2 (n° 1, 6, 7, 8).
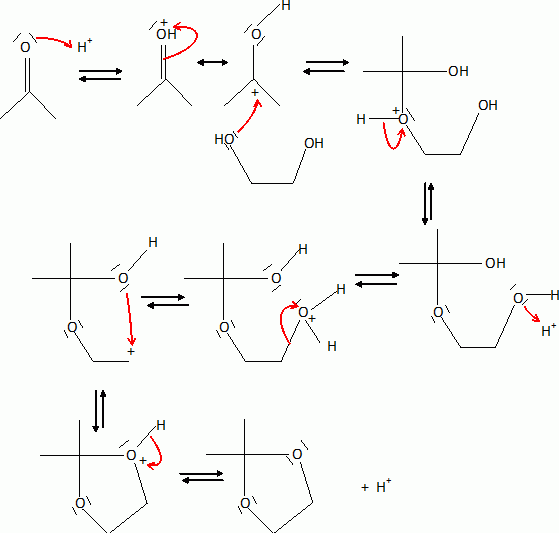
Donner le mécanisme du passage de 8 à 9 en utilisant des notations simplifiées.
|
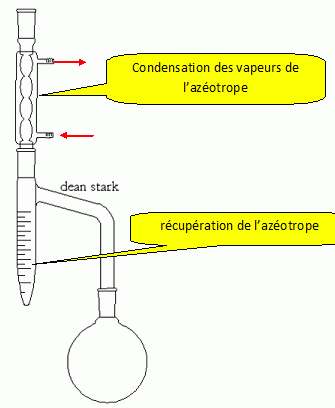
Dessiner
le montage utilisé lors du passage de 8 à 9 et préciser comment
l'utilisation d'un appareil de Dean-Stark permet d'améliorer le
rendement de la réaction.
Le but d'un appareil
de Dean-Stark est d’enlever l’eau du milieu. Pour cela, on ajoute un
solvant afin de former avec l’eau un hétéroazéotrope dont la
température d’ébullition sera la plus faible de tous les composés
présents.
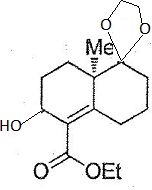
Le composé 9 est ensuite traité par le tétrahydroborate de sodium dans
l'éthanol absolu à 0°C pendant deux heures ; après retour à température
ambiante, le composé 10 de formule brute C16H24O5 est obtenu.
Donner la structure du composé 10 sans préciser la stéréochimie. Pourrait-on remplacer NaBH4 par LiAlH4 ? Justifier.
Réduction de la cétone en alcool par un réducteur doux NaBH4. En utilisant LiAlH4, on réduirait également l'ester en alcool correspondant.
Quels changements significatifs doivent apparaître sur le spectre IR du composé 9 par rapport à celui du composé 6 ?
Disparition de la bande à 1674 cm-1 : v C=O de la cétone conjuguée.
Apparition d'une large bande ( v O-H associé par liaison hydrogène) entre 3100 et 3500 cm-1.
|











