|
|
Cette
méthode met en oeuvre une minéralisation des substances organiques par
de l'acide sulfurique concentré et chaud. Les atomes de carbone de la
substance se retrouvent sous forme de CO2 et les atomes
d'azote sous forme d'ion ammonium : on appelle "masse d'azote Kjeldahl
" la somme des masses d'azote sous forme d'ammoniac, ammonium et
organique dans un échantillon.
Etape1.
Un prélevement de terre est séché, broyé et tamisé, puis on introduit
2,556 g de cette terre dans un tube à minéraliser ( tube à essais épais
). On ajoute environ 10 mL d'acide sulfurique concentré ( à 18 mol/L),
une pointe de spatule de catalyseur à base de sélénium ( 0,5 g) et on
place le tube dans un digesteur ( chauffe-tubes ) installé sous la
hotte avec un entonnoir en verre sur le tube. On chauffe à ébullition
pendant au moins une heure et le tube est sorti du digesteur puis
refroidi. On ajoute alors très lentement en refroidissant dans un bain
d'eau froide et en portant des lunettes de protection, environ 30 mL
d'eau puis on transvase ( le long d'un agitateur en verre ) le contenu
de ce tube dans l'ampoule de coulée situé en haut et à droite du
montage ci-dessous, le robinet inférieur étant ouvert. Le tube à
minéraliser et l'ampoule de coulée sont rincés et les eaux de rinçage
récupérées.
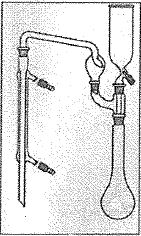
Etape 2. Distillation.
Ajouter tois ou quatre grains de pierre ponce et deux gouttes de
solution de phénolphtaléine ( indicateur coloré dont la zone de virage
se situe dans l'intervalle de pH : 8,0 ; 9,9 et dont la forme basique
est rose ) dans le matras ( ballon à col long ) contenant le mélange
précédent et plonger le tube inférieur du réfrigérant droit dans un
becher contenant 20,0 mL de solution d'acide sulfurique à 0,0500 mol/L
et environ 60 mL d'eau.
Verser dans l'ampoule de la soude très concentrée et faire couler
jusqu'au virage au rose de la phénolphtaléine en agitant légèrement.
Distiller pendant une vingtaine de minutes, vérifier que le distillat
est neutre ( papier pH) sinon distiller encore quelques minutes.
Etape 3.
Titrer la solution du becher qui a reçu le distillat par une solution
de soude à 0,1220 mol/L en présence de rouge de méthyle ( zone de
virage dans l'intervalle de pH : 4,2 - 6,2).
Justifier les mesures de précaution prises lors de l'ajout d'eau dans le tube à minéraliser refroidi.
On ajoute de l'eau dans une solution concentrée d'acide sulfurique : il faut se protéger d'éventuelles projections d'acide.
Calculer
le volume approximatif de soude à 10 mol/L qu'il faudra verser avant la
distillation pour neutraliser l'acide sulfurique.
L'acide sulfurique est un diacide : nsoude = 2 n acide sulfurique = 2*18*0,010 = 0,36 mol.
Volume de soude : n / Csoude =0,36 / 10 = 0,036 L = 36 mL.
|
.
Ecrire
l'équation de la réaction de l'espèce azotée avec la soude lorsu'on
verse la solution de soude dans le matras et préciser le rôle de la
phénolphtaléine.
NH4+aq + HO- aq= NH3 aq + H2O.
La phénolphtaléine permet de repérer la fin de la réaction acide base entre les ions ammonium et hydroxyde.
Ecrire l'équation de la réaction mis en oeuvre dans le becher qui reçoit le distillat.
Les vapeurs d'ammoniac sont entraînées par la vapeur d'eau lors de la
distillation. L'ammoniac réagit avec la solution d'acide sulfurique en
excès.
NH3 aq + H3O+aq = NH4+aq + H2O.
L'excès d'acide sulfurique est titré ( titrage indirect ) par une solution de soude.
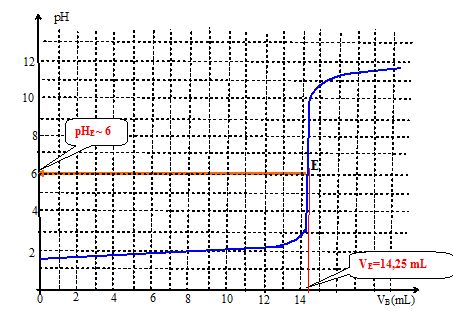
Au virage de l'indicateur, le volume versé de solution de soude est 14,25 mL.
Calculer
la masse "d'azote Kjeldahl" contenue dans l'échantillon et déduire la
masse ( g) d'azote Kjeldahl par kg de sol étudié.
L'acide sulfurique est un diacide : nsoude = 2 n acide sulfurique excès = 14,25 *0,1220 =1,7385 mmol.
n acide sulfurique excès =1,7385 / 2 =0,86925 mmol.
n acide sulfurique initial =20,0 *0,0500 = 1,00 mmol.
n acide sulfurique réagi =1,00 - 0,86925 =0,13075 ~0,131 mmol.
nNH3 = 2 n acide sulfurique réagi =2*0,13075 =0,2615 mmol.
nNH3 =nNH4+ = 0,2615 mmol.
Masse d'azote : nNH4+ M(N) = 0,2615 *14,01 =3,664 mg dans 2,556 g de terre.
3,664*1000 / 2,556 = 1,433 g d'azote par kg de terre.
Dessiner un allure de la courbe qu'on aurait obtenue si le titrage de l'étape 3 avait été suivie par pH-métrie. ( La valeur pH=7 devra apparaître sur l'axe des ordonnées ainsi que toutes les données disponibles ).
Les deux acidités de l'acide sulfurique sont dosés simultanément. pKa( HSO4- / SO42-) = 2.
La solution contenant des ions ammonium, le pH équivalent sera inférieur à 7.
|
.

