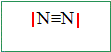|
|
Le principe de la théorie de la combustion qui prévaut au XVIIIe
siècle est qu'un corps qui brûle perd une substance combustible appelée
"phlogistique" : c'est en quelque sorte du feu répandu dans la matière
qui s'en échappe au moment de la combustion, jusqu'à éventuellement
en saturer l'air en fin de combustion ( par exemple à la fin de
la combustion d'une bougie sous une cloche). Les résidus de la
combustion d'un métal, les chaux métalliques sont donc dépourvus de
cette substance. Seul le carbone, riche en phlogistique, peut le
restituer pour régénérer le métal.
A cette époque, les gaz sont de
l'air chargé de diverses impuretés. Par exemple J Black en 1754
identifie l'air fixe en chauffant du calcaire ( carbonate de calcium) ,
H Cavendish isole en 1766 l'air inflammable obtenu lors de la réaction
d'un acide sur u métal et J Priestley isole en 1774 l'air
déphlogistiqué ( gaz qu'il obtient par chauffage de l'oxyde de mercure
rouge HgO ) et le distingue de l'air phlogistiqué ( gaz saturé en
phlogistique, constituant de l'air ordinaire). En 1781, Cavendish
constate que deux volumes d'air inflammable se combinent à un
volume d'air déphlogistiqué pour donner de l'eau.
Donner les noms des gaz cités dans le texte.
Air inflammable : dihydrogène H2 ; air déphlogistiqué : dioxygène O2 ; ; air phlogistiqué : diazote N2.
Comment nomme-t-on actiellement les chaux métalliques ?
Les oxydes métalliques.
Comment interprète-t-on aujourd'hui le fait que le carbone puisse régénérer un métal à partir des chaux métalliques.
Le carbone réduit les oxydes métalliques en métaux ; le carbone s'oxyde en oxydes de carbone.
La
mise en évidence du gaz diazote est attribuée à D Rutherford en 1772.
Il fit brûler du carbone dans l'air et piégea le dioxyde de carbone
obtenu dans une solution aqueuse basique.
Ecrire l'équation de la réaction de piégeage du dioxyde de carbone.
CO2 + 2Na+ +2HO- ---> CO32- +2Na++ H2O.
En
1776 Lavoisier écarte la théorie du phlogistique en prouvant que le
dioxygène de l'air se combine aux métaux quand on les brûle. Ce gaz qui
s'appelle d'abord ' air vital" est nommé ensuite oxygène. C'est encore
Lavoisier qui donne son nom au diazote.
En 1783 Cavendish fait une
analyse de l'air plus précise et conclut à un pourcentage de 20,83 % en
voume de dioxygène et 79,17 % de diazote, et c'est en 1892 seulement
que Rayleigh détermine lamasse volumique du diazote, mais il ne
comprend pas alors pourquoi le diazote atmosphérique ( obtenu par
passage d'un échantillon d'air sur du cuivre chauffé au rouge puis
élimination des traces d'eau et du dioxyde de carbone ) a une masse
volumique différente de celle du diazote himique obtenu par
décomposition d'ammoniac sur l'oxyde de cuivre (II).
En quelle classe du collège ou du lycée les élèves mesurent-ils la masse d'un volume de gaz ?
Classe de quatrième collège.
Décrire succinctement une expérience permettant de mesurer la masse d'un litre d'air.
Peser
une bouteille d'eau de 1 L en plastique ( vide d'eau) ou d'un ballon sur une balance de précision ;
écraser complètement cette bouteille afin d'en chasser l'air. Peser à
nouveau la bouteille écrasée. La différence des deux pesées donne la
masse d'un litre d'air.
|
.
Obtention du diazote atmosphérique par passage de l'air sur du cuivre incandescent.
On
considère une enceinte fermée, contenant initialement de l'air, dans
laquelle du cuivre chauffé au rouge, à une température T = 1200 K, est
transformé en oxyde de cuivre CuO par le dioxygène selon :
2 Cu(s) + O2(g) = 2 CuO(s). (1)
Calculer la constante d'équilibre de la réaction (1) à 1200 K.
DfH°(CuO(s)) = -157,3 kJ /mol ; S°(Cu(s)) =33,2 JK-1mol-1 ; S°(CuO(s)) =42,6 JK-1mol-1 ; S°(O2(g)) =205,2 JK-1mol-1.
DS° = 2 S°(CuO(s)) - S°(O2(g))-2S°(Cu(s)) =2*42,6 -205,2-2*33,2 = -186,4 JK-1mol-1.
DrG°=DfH° -T DS° = -157,3 103 -1200(-186,4) =-3,81 105 J mol-1.
ln K1 (1200) = -DrG° / (RT) =3,81 105 /(8,31 *1200) =38,2 ; K1 (1200) =3,85 1016.
En déduire,
dans l'hypothèse ou le cuivre est en excès sur le dioxygène, la
pression partielle en dioxygène à l'équilibre à 1200 K .
K = P° / PO2 ; PO2 = P°/K ; P° : pression de référence égale à 1 bar et PO2, pression partielle en dioxygène.
PO2 = 1 / (3,85 1016) =2,6 10-17 bar.
Proposer une
méthode pour éliminer les traces d'eau résiduelles dans le gaz obtenu
après passage de l'air sur le cuivre chauffé au rouge.
Barbotage dans un liquide qui retiendra l’eau :
H2SO4 concentré, potasse concentrée.
Passage dans une colonne à dessécher ou dans un tube en U rempli d’un des
desséchants notés ci-dessus, inertes vis à vis du gaz.
Obtention du "diazote chimique" par oxydation de l'ammoniac.
Ecrire l'équation de la réaction d'oxydation de l'ammoniac en diazote par le dioxygène.
2 NH3(g) + 1,5 O2(g) = N2(g) + 3 H2O(g).
Quel(s) autre(s) gaz azoté(s) est ( sont ) a priori envisageable(s) comme produit(s) de cette oxydation ?
NO qui en présence de dioxygène s'oxyde en NO2.
Proposer une méthode permettant l'élimination de l'ammoniac en excès dans le gaz ainsi obtenu .
Faire barboter le gaz obtenu dans l'acide sulfurique concentré.
On
admet que les conditions opératoires utilisées par Rayleigh lui ont
permis d'oxyder l'ammoniac exclusivement en disazote et d'éliminer
totalement les sous produits et les réactifs résiduels.
Quel est le volume molaire d'un gaz parfait à 298 K sous pression P° = 1,00 105 Pa ?
Vm = RT / P° = 8,314 * 298 / (1,00 105) = 2,48 10-2 m3 mol-1.
Raleigh a mesuré les masses volumiques r des gaz ( supposés parfaits ) dans les conditions où leur volume molaire est V* = 22,42 L/mol, il a obtenu :
r(" diazote atmosphérique") =1,256 g/L et r(diazote chimique") =1,249 g/L.
En déduire la masse molaire M1 du "diazote atmosphérique" et la masse molaire M2 du "diazote chimique".
M1 = 1,256 *22,42 = 28,16 g/mol ; M2 = 1,249 *22,42 = 28,00 g/mol.
Calculer
la proportion de dioxygène dans le diazote atmosphérique qui
justifierait l'écart entre ces deux masses molaires. Cette composition
est-elle crédible au vu des résultats précédents ?
x : proportion de dioxygène : x M(O2) + (1-x) M(N2) = 28,16.
32,00 x + (1-x)28,02 = 28,16 ; x = 3,5 10-2 ( 3,5 %).
Cette composition n'est pas crédible au vu de la pression partielle en
dioxygène résiduel après passage de l'air sur le cuivre chauffé.
Comment peut-on interpréter l'écart de ces mesures avec les connaissances scientifiques actuelles ?
L'air contient également des gaz rares ( argon 0,93 %, du néon, du krypton... ) et du dioxyde de carbone 0,038 %.
l'atome d'azote.
Dans l'écorce terrestre d'environ 30 km d'épaisseur ( océans et
atmosphère compris) l'élément azote est très peu abondant par
rapport aux deux éléments les plus abondants.
Citer ( par ordre décroissant ) les deus éléments les plus abondants en pourcentage massique dans l'écorce terrestre.
Oxygène ( 46,6 % ) et silicium ( 27,7 % ) dans les silicates.
Citer ( par ordre décroissant ) les deux éléments les plus abondants en pourcentage massique dans l'univers entier.
Hydrogène, hélium.
Quelle est la configuration électronique de l'atome d'azote dans son état fondamental ?
1s2 2s2 2p3.
Expliciter
clairement la stratégie adoptée pour déterminer les numéros atomiques
de tous les éléments situés sous l'azote dans la classification
périodique et donner ces numéros.
On passe de l'azote au phosphore en ajoutant 8 électrons à l'atome d'azote 15 P.
Ensuite il faut ajouter 8+10 ( sous couche d saturée )soit 18 : 33As ; 51Sb.
Puis prendre en compte l'occupation de la sous couche f saturée à 14 électrons : 8 +10 +14 = 32 ; 83 Bi.
Citer deux éléments situés dans la même colonne de la classification périodique que l'azote.
Phosphore, arsenic, antimoine.
La molécule de diazote.
Ecrire la formule de Lewis de cette molécule.
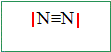
Evaluer l'ordre de grandeur de la masse de diazote contenue dans l'atmosphère terrestre.
La plus grande partie de la masse atmosphérique est proche de la surface de la terre. ( 15 km d'épaisseur
Volume de la terre : 4/3 p RT3 =4/3*3,14 (6,38 106 ) ~ 1,0879 1021 m3.
Volume d'une sphère de rayon RT +50 km : 4/3 p R3 =4/3*3,14 (6,395 106 )3 ~ 1,095 1021 m3.
Volume de l'atmosphère ~ 7,0 1018 m3.
Volume de diazote : 0,8 * 7,0 1018 ~5,6 1018 m3.
r diazote =1,2 kg m-3 ; masse de diazote : 5,6 1018 *1,2 ~6,7 1018 kg.
|
.
|