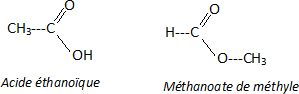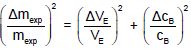|
|
L'une
des propriétés pharmacologiques de l'aspirine est d'être un fluidifiant
du sang. C'est pourquoi l'aspirine peut être utilisée de manière
préventive pour diminuer le risque de formation de caillots sanguins
responsables des accidents vasculaires cérébraux ( AVC). L'aspirine est
alors prescrite à faible dose : 75 à 150 mg/jour.
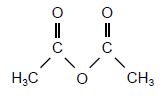
Anhydride éthanoïque
|
|
M = 102 g/mol ; µ =1,0282 kg /L.
Liquide incolore d'odeur piquante.
Tébullition = 136,4 °C sous 1 bar.
Soluble dans l'eau et l'éthanol.
|
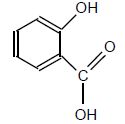
Acide salicylique
|
|
M = 138 g/mol ; solide blanc.
Tfusion : 159°C.
Peu soluble dans l'eau à froid, soluble à chaud.
Très soluble dans l'éther et dans l'alcool.
|
Aspirine
|
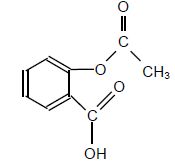
|
M = 180 g/mol.
Solide blanc, se décomposant à la chaleur à partir de 128°C.
Solubilité dans l'eau : 3,3 g/L à 25°C.
Très soluble dans l'éthanol.
|
Synthèse de l'aspirine.
L'aspirine peut être synthétisée à partir d'acide salicylique et d'anhydride éthanoïque.
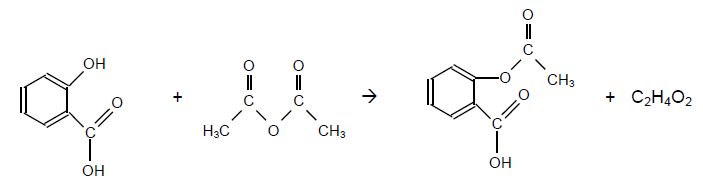
La chromatographie sur couche mince (CCM) est une technique qui permet de contrôler la réaction chimique.
Préparer un bain marie à la température de 70°C.
Dans un erlenmeyer bien sec, sous hotte, introduire 10,0 g d'acide
salicylique, 14,0 mL d'anhydride éthanoïque et quelques grains de
pierre ponce.
Réaliser un premier prélèvement du milieu réactionnel en vue d'une analyse sur CCM.
Adapter un réfrigérant à air sur l'erlenmeyer.
A la date t=0, placer l'erlenmeyer dans le bain marie.
Laisser réagir pendant 20 min tout en réalisant 4 nouveaux prélèvements du milieu réactionnel toutes les 4 minutes.
|
|
Montrer que l'anhydride éthanoïque est en excès.
n( anhydride) = 14,0*1,0282 / 102 = 0,141 mol ; n( acide salicylique) = 10,0 / 138 =7,25 10-2 mol.
Les réactifs réagissent mole à mole : l'anhydride est donc en excès.
Calculer la masse attendue d'aspirine.
On peut obtenir au mieux 7,25 10-2 mol d'aspirine soit 7,25 10-2 *180 = 13,0 g.
Proposer un protocole expérimental pour réaliser les différentes chromatographies.
La chromatographie sur couche mince ( CCM) permet de déparer et d'identifier les
constituants d'un mélange.
Il faudra deux espèces pures, l'acide salicylique
et l'aspirine, servant de référence. Le troisième dépôt sera réalisé à partir du milieu réactionnel.
|
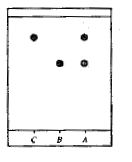
éluant : mélange cyclohexane
acétone
Sur la plaque de silice on effectue trois
dépôts à l'aide de capillaires
A : cristaux obtenus par synthèse
B : aspirine pure ; C : acide salicylique
Après révélation sous lampe
UV ( 254 nm) on obtient le chromatogramme ci-contre, en cours de synthèse
:
|
en cours de synthèse
:
|
à l'état final.

|
Quelles
particularités doit présenter le chromatogramme obtenu avec le dernier
prélèvement, en admettant que le système réactionnel est dans on état
final ?
L'acide salicylique étant en défaut et la réaction chimique étant
totale, ce dernier chromatogramme aura l'aspect ci-dessus, à droite.
|
.
|
Analyse spectrale.
Recopier la formule de la molécule d'aspirine et identifier les deux groupes caractéristiques.
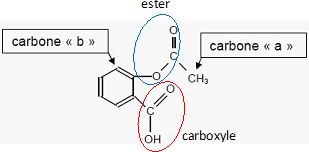
Deux carbones particuliers sont repérés par les lettres a et b dans la molécule d'aspirine.
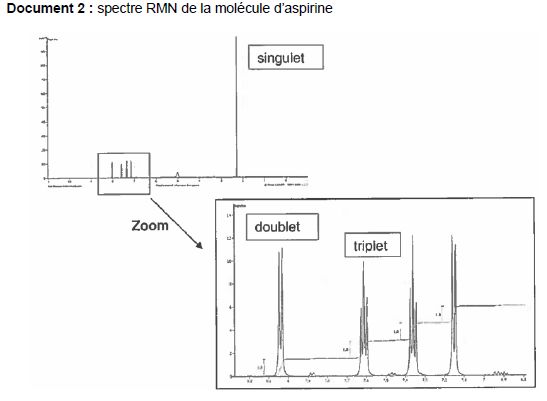
Expliquer pourquoi les atomes d'hydrogène liés au carbone "a" correspondent au singulet.
Le carbone situé en alpha du carbone "a" ne porte pas d'atomes
d'hydrogène. Les trois hydrogènes équivalents du carbone "a" ne sont
pas couplés avec d'autres protons, d'où un singulet.
Justifier de mêm que le doublet correspond à l'atome d'hydrogène porté par le carbone"b".
Parmi les deux atomes de carbone situé en alpha du carbone "a" , un seul porte un atome
d'hydrogène unique. Le proton porté par le carbone "b" est couplé avec un seul autre atome d'hydrogène, d'où un doublet.
Donner la formule semi-développée de l'acide éthanoïque et du méthanoate de méthyle qui est un isomère de l'acide éthanoïque.
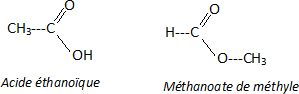
On donne les spectre IR de ces deux espèces.
Identifier celui qui correspond à l'acide éthanoïque en justifiant.
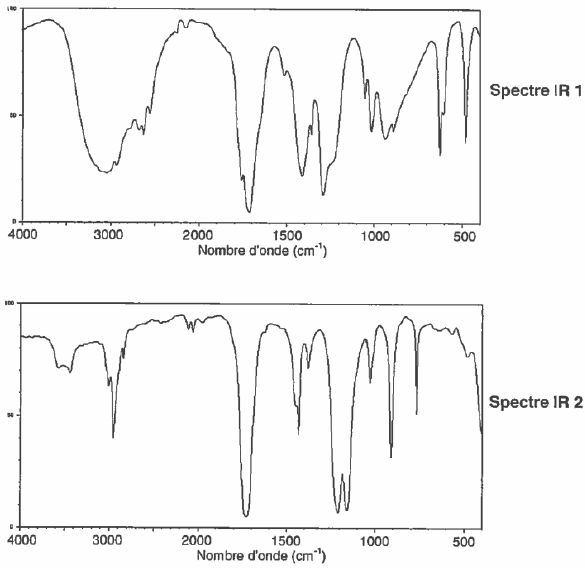
Le spectre IR1 présentant une large bande entre 2800 et 3200 cm-1( OH lié par liaison hydrogène) correspond à celui de l'acide éthanoïque.
Sur les deux spectres on trouve la bande de vibration du groupe C=O vers 1700 cm-1.
|
|
Dosage d'un sachet d'aspirine.
L'étiquette porte la mention " aspirine 100 mg".
Un élève se propose de vérifier la teneur en aspirine, notée AH, de ce sachet.
Il
prépare une solution S en introduisant l'aspirine contenue dans le
sachet dans une fiole jaugée, puis en ajoutant de l'eau distillée pour
obtenir une solution de volume V = 500 mL.
Il prélève ensuite un volume Va = 100 ±0,1 mL de cette solution S qu'il dose avec une solution aqueuse d'hydroxyde de sodium de concentration molaire Cb =(1,00 ±0,02) 10-2 mol/L en présence de phénolphtaléine. On donne VE = 10,7 ±0,1 mL.
Ecrire l'équation de la réaction support du dosage.
AH aq + HO-aq ---> A-aq + H2O(l).
Calculer la masse d'aspirine mexp.
A l'équivalence la quantité de matière d'aspirine est égale à la quantité de matière de soude :
n = CbVE = 1,00 10-2 *10,7 10-3=1,07 10-4 mol dans 100 mL soit 5*1,07 10-4 =5,35 10-4 mol dans 500 mL.
mexp = n M(aspirine) = 5,35 10-4 *180 =9,63 10-2 g = 96,3 mg.
Déterminer l'incertitude relative Dmexp / mexp sachant que :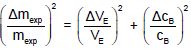
(Dmexp / mexp)2 =(0,1 / 10,7)2 + (0,02 / 1,00)2=8,73 10-5 +4,0 10-4 =4,87 10-4 ; Dmexp / mexp= 2,21 10-2.
En déduire un encadrement de mexp.
Dmexp = 2,21 10-2*96,3 =2,1 mg ; mexp= 96,3 ±2,1 mg.
L'encadrement
précédent est-il en accord avec la mention portée sur le sachet
d'aspirine ? Proposer une explication à l'écart éventuellement oobservé.
La vaeur "100 mg" portée par l'étiquette est en dehors de l'encadrement précédent.
Si la solution d'hydroxyde de sodium n'est pas fraîchement préparée, la soude peut être carbonatée et la concentration Cb est fausse.
L'aspirine possède une base conjuguée, l'ion acéthylsalicylate. Le pKa du couple acide / bas ainsi constitué est égal à 3,5.
Lors de la digestion, le pH de l'estomac est voisin de 2.
Quelle est la forme prédominante du couple présente dans l'estomac ? Justifier.
A pH inférieur au pKa, la forme acide AH du couple acide / base prédomine.
L'aspirine pouvant provoquer des lésions gastriques, on trouve dans le
commerce des formulations différentes, moins aggressives pour la paroi
gastrique, comme la catalgine ( acéthylsalicylate de sodium ). Dans
l'estomac, les ions acéthylsalicylate réagissent avec les ions H3O+
pour redonner de l'aspirine qui précipite. Ce précipité, obtenu sous
forme de grains microscopiques, est plus facilement assimilable.
Ecrire la formue semi-développée de l'ion acéthylsalicylate.
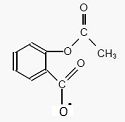
Expliquer pourquoi la catalgine est soluble dans l'eau.
La catalgine contient deux espèces ioniques, l'ion sodium et l'ion
acéthylsalicylate. La catalgine est donc très soluble dans un solvant
polaire comme l'eau.
Donner l'équation de la réaction se produisant dans l'estomac après ingestion de la catalgine.
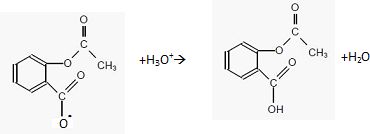
|
|