|
|
L'usage
du vinaigre date d'environ cinq mille ans, celui-ci ayant été découvert
à partir de jus de fruits abandonnés à l'air libre qui se sont
transformés. Il fut le premier médicament antibactérien de notre
histoire, permettant de lutter contre la propagation d'épidémies comme
la peste. Les femmes en ont aussi fait un soin de beauté pour faire
briller leurs cheveux. Actuellement on l'utilise pour conserver les
aliments mais aussi à des fins culinaires. Certains vinaigres élaborés
avec des fleurs, reviennent au goût du jour depuis quelques années.
Dans
son entreprise artisanale " Fleurs et saveurs", Julie conçoit un
vinaigre aux fleurs de violette ou " vignaigre violat" dans des fûts de
chêne selon une recette très ancienne. Julie fait macérer des fleurs de
violette odorante penandant une dizaine de jours dans du vinaigre
obtenu par fermentation d'un vin blanc en présence d'une bactérie,
nommée Mychoderma acéti.
Après filtration, le vinaigre aux fleurs de
violette a une teinte violacée très foncée. L'étiquette représentée
ci-dessous est apposée sur chaque bouteille après le conditionnement de
chaque production.

l'objectif
de cet exercice est de déterminer si les résultats obtenus par Julie
lors de l'analyse d'une production de vinaigre aux fleurs de violette
sont compatibles avec l'étiquette. Julie réalise pour cela un titrage
par pH-métrie pour détrminer le degré d'acidité du vinaigre. Elle
s'assure ensuite de la présence d'a-ionone, un des principaux composants de la violette, grâce à une chromatographie sur couche mince.
On donne M(acide éthanoïque) = 60 g/mol ; rvinaigre = 1,0 g/ mL.
Titrage du vinaigre aux fleurs par pH-métrie.
Julie dispose d'une solution S0
de vinaigre aux fleurs de violette de sa dernière production dont elle
cherche à déterminer le degré d'acidiité. L'acide contenu dans le
vinaigre est de l'acide éthanoïque à la concentration c0.
Préparation d'une solution diluée de vinaigre aux fleurs de violette.
le vinaigre fabriqué étant trop concentré, il est nécessaire de le diler 10 fois pour préparer la solution S à titrer.
Etablir la
liste du matériel de verrerie nécessaire pour préparer précisément V =
50,0 mL de solution S diluée dont on notera la concentration molaire
apportée cs.
Fiole jaugée de 50,0 mL, pipette jaugée de 5,00 mL, bechers et pissette d'eau distillée.
Titrage de l'acide éthanoïque contenu dans la solution S.
Un volume Vs = 10,0 mL de solution S est titré par une solution aqueuse d'hydroxyde de sodium de concentration cb = 0,100 mol/L selon la réaction d'équation :
CH3COOH aq + HO-aq ---> CH3COO-aq + H2O(l).
Définir un acide selon Brönsted.
Un acide est une espèce chimique susceptible de céder un proton H+.
Identifier les couples acide / base mise en jeu.
CH3COOH aq / CH3COO-aq ; H2O(l) / HO-aq.
Définir l'équivalence du titrage.
A
l'équivalence les quantités de matière des réactifs sont en proportions
stoechiométriques. Avant l'équivalence, l'un des réactifs est en
excès, après l'équivalence, l'autre réactif est en excès.
|
.
Déterminer graphiquement le volume VBE qu'il a fallu verser à l'équivalence.
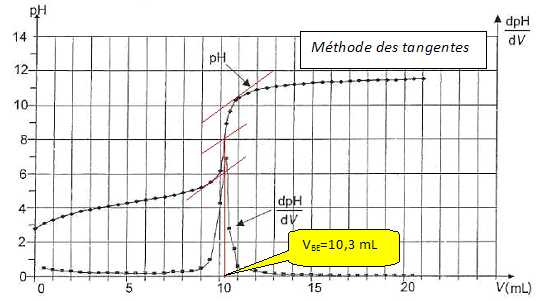
Etablir l'expression littérale de la concentration cs.
A l'équivalence : Vs cs = VBE cb ; cs = VBE cb / Vs.
En déduire la cocentration c0.
c0 = 10 cs = 10 VBE cb / Vs = 10*10,3 *0,100 / 10,0 = 1,03 mol/L.
Les indicateurs colorés sont aussi utilisés pour les titrages acido-basiques.
Julie aurait-elle pu réaliser un dosage en présence d'un indicateur colorer pour titrer ce vinaigre ?
Le
vinaigre aux fleurs de
violette a une teinte violacée très foncée. Le changement de couleur
d'un indicateur coloré ne pourra pas être détecté. Un dosage avec
indicateur coloré n'est donc pas possible.
Détermination du degré du vinaigre.
Le degré d'un vinaigre exprime la masse en grammes d'acide éthanoïque pur contenu dans 100 g de vinaigre.
Déterminer le degré d d'acidité du vinaigre.
Masse d'acide pur dans 1 L de vinaigre : m = M(acide acétique ) c0 = 60 *1,03 = 61,8 g /L.
Masse de 1 L de vinaigre : 1,00 kg ; degré du vinaigre : d= 6,18 ~ 6,2 °.
L'étiquette peut être apposée sur les bouteilles si le degré du vinaigre déti est indiqué avec une incertitude relative |(déti-d) / déti | inférieure à 10 %.
L'étiquette doit-elle être modifiée ? Si oui, avec quelle valeur 5, 6, 8 ou 9° ?
|(déti-d) / déti | = (7-6,2) / 7 = 0,11 ( 11 %). L'étiquette doit donc porter la valeur 6°.
Chromatographie du vinaigre aux fleurs de violette.
Julie veut vérifier la présence de l'a-ionone
dans son vinaigre. Pour cela elle dépose sur une plaque de
chromatographie, avec une micropipette, quelques gouttes des composés
suivants :
A : vinaigre aux fleurs de violette ; B : acide éthanoïque ; C : a-ionone de synthèse.
Après élution de la plaque et révélation, on obtient le chromatogramme suivant.
Quels sont les objectifs d'une chromatographie sur couche mince ?
Séparer et identifier les constituants d'un mélange.
Légender le chromatogramme.
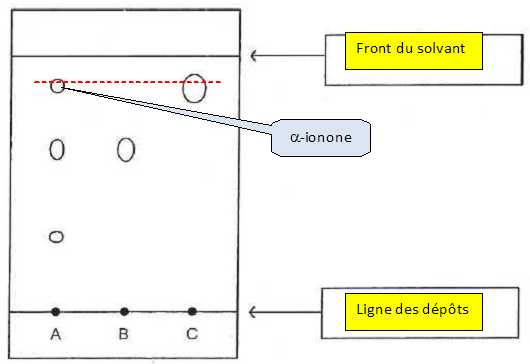
Julie peut-elle identifier la présence d'a-ionone dans son vinaigre ? Justifier.
Après élution et révélation, le vinaigre aux violette A, présente une tache ayant le même rapport frontal que l'étalon C, a-ionone. Le vinaigre contient donc de l'a-ionone.
|
.
|