|
|
On donne
la formule semi-développée de l'acide lactique.
Donner la formule
topologique, identifier les groupes caractéristiques présents,
représenter les stéréoisomères.
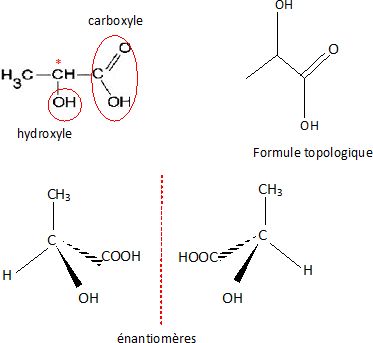
Justifier
la chiralité et préciser le type d'isomérie.
La présence d'un atome de carbone asymétrique conduit à l'existence de
deux énantiomères.
Parmi
les spectres IR proposés ci-après, choisir en justifiant celui
correspondant à l'acide lactique.
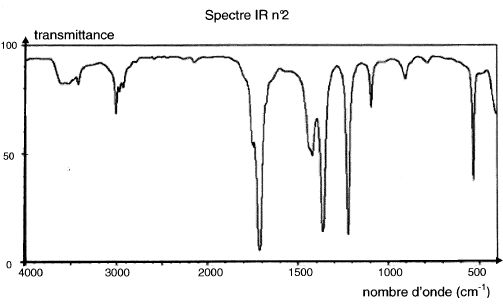
L'absence d'une large bande vers.3000 - 3500 cm-1 est
incompatible avec la présence de groupe OH lié par liaisons hydrogène.
Ce spectre IR ne correspond pas à celui de l'acide lactique.
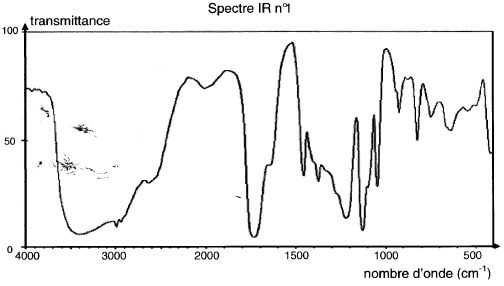
Ce spectre IR correspond à celui de l'acide lactique :
2500 - 3200 cm-1 : OH d'un acide carboxylique lié par
liaisons hydrogène.
3200 - 3700 cm-1 : OH d'un alcool lié par liaison hydrogène.
1710 cm-1 : pic intense du au groupe C=O.
Prévoir
en justifiant le nombre de signaux présents dans le spectre RMN de
l'acide lactique ainsi que leur multiplicité.
Les trois protons du groupe méthyle sont
équivalents et couplés avec le proton du carbone n°2 : doublet.
Le proton du carbone n°2 est couplé avec les trois protons du groupe
méthyle : quadruplet.
On observe deux singulets correspondants aux protons de la fonction
alcool et acide carboxylique.
|
.
|
Dosage de
l'acide lactique après une phase de test.
Le test d'effort d'un cheval est constitué de plusieurs phases. Durant
chacune d'elles, le cheval se déplace à une vitesse constante qui est
augmentée d'une phase à l'autre et on mesure sa fréquence cardiaque
ainsi que sa vitesse. Une prise de sang est effectuée à l'issue de
chaque temps d'effort afin de doser l'acide lactique.
Le cheval court pendant trois minutes à la vitesse de 500 m / min. Un
vétérinaire prélève sur ce cheval un volume V = 1,00 mL de sang dont il
extrait l'acide lactique. Cet acide est dissout dans l'eau pour obtenir
une solution S de volume Vs = 50,0 ±0,05 mL. Il réalise le
dosage de la totalité de cette solution S par une solution aqueuse
d'hydroxyde de sodium Na+aq + HO-aq de
concentration C1 = (1,00±0,01)10-3 mol/L.
L'équivalence est obtenue pour un volume de solution d'hydroxyde de
sodium ajoutée VE = 4,0 ±0,4 mL.
Ecrire
l'équation de la réaction support du dosage.
L'acide lactique est noté AH. AH aq + HO-aq
---> A-aq + H2O(l).
Exprimer
la concentration molaire Cs en acide lactique
puis calculer sa valeur.
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques.
CsVs = C1 VE ; Cs= C1 VE / Vs= 1,00 10-3 *4, 0 / 50, 0 =8,0 10-5
mol/L.
L'incertitude relative d'une grandeur X est définie par le rapport DX / X.
On admet qu'un incertitude relative est négligeable devant une autre si
elle est dix fois plus petite. Dans l'hypothèse où les incertitudes
relatives sur Vs et C1 sont négligeables devant
celle sur VE, on admet que l'incertitude relative DCs / Cs est
égale à DVE / VE.
En
déduire l'encadrement de la concentration molaire C en acide lactique
dans le sang du cheval.
DVE
/ VE = 0,4 / 4 = 0,10 ; DCs
/ Cs = 0,10 ; DCs
= 8,0 10-5*0,10 = 8,0 10-6 mol/L.
Cs
= (8,0 ±0,8 ) 10-5 mol/L.
Evaluation de la
condition physique du cheval.
Un cheval a subi un teste similaire trois semaines auparavant.
Donnée : Pour une vitesse donnée, un cheval est d'autant plus
performant que la concentration en acide lactique de son sang est
faible.
Le graphe suivant donne la concentration massique en acide lactique à
l'issue de différentes phases d'un test d'effort en fonction de la
vitesse, pour un test réalisé trois semaines auparavant.
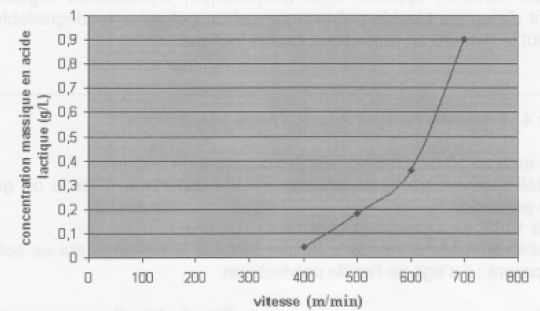
Le paramètre V4 est défini par la valeur de la vitesse qui
correspond à une concentration en acide lactique de 0,36 g/L. Ce
paramètre est assimilable à un seuil de fatigue. Il dépend de l'âge du
cheval, de son niveau d'entraînement et de sa capacité individuelle à
l'effort. D'après http : //pegase.mayenne.
Le
cheval examiné est-il en meilleure forme que trois semaines auparavant
?
Masse molaire acide lactique M = 90,0 g/L.
Concentration massique de l'acide lactique dans le sang du cheval :
8,0 10-5 *50 10-3 = 4,0 10-6
mol d'acide lactique dans 1 mL de sang ou 4,0 10-3 mol dans
un litre de sang.
4,0 10-3*90 =0,36 g d'acide lactique dans un litre de
sang.
Le cheval a aujourd'hui atteint le seuil de la fatigue alors que trois
semaines auparavant il était en meilleure forme ( 0,2 g/L d'acide
lactique après une course de trois minutes à 500 m / min ).
|
|
Polymérisation de l'acide lactique.
Une molécule d'acide lactique peut , dans certaines conditions, réagir
avec une autre molécule d'acide lactique pour former une molécule de
chaîne plus longue, à six atomes de carbone. A son tour cette dernière
peut réagir avec une autre molécule d'acide lactique pour former une
molécule encore plus longue et ainsi de suite.
On obtient ainsi une molécule de polymère constituée d'un grand nombre
d'atomes de carbone, appelée acide polylactique, reproduisant
régulièrement le même motif d'atomes. L'acide polylactique est un
polymère biodégradable : l'action de l'eau peut le détruire en
régénérant l'acide lactique.
Protocole de synthèse de l'acide polylactique ( http://www.ac-nancy-metz.fr )
Introduire environ 10 mL d'acide lactique dans un becher.
Ajouter délicatement quelques gouttes d'acide sulfurique à l'aide de gants et lunettes de protection.
Chauffer à 110 °C en agitant régulièrement.
Au bout d'environ 30 minutes, laisser refroidir le mélange qui se
solidifie mais reste transparent : il s'agit d'acide polylactique.
La polymérisation de l'acide lactique est-elle lente ou rapide ? Justifier.
Cette polymérisation est lente : en présence d'un catalyseur, l'acide
sulfurique, et en travailant à 110°C, 10 mL d'acide lactique sont
polymérisés en 30 minutes.
Citer un paramètre influençant l'évolution temporelle de cette réaction chimique.
Un catalyseur, la température sont des facteurs cinétiques.
Proposer un protocole permettant de vérifier que l'acide sulfurique est un catalyseur de cette réaction.
Recommencer plusieurs fois l'expérience en lmodifiant seulement la
quantité d'acide sulfurique et noter au bout de combien de temps on
obtient l'acide polylactique.
|
|