|
|
Les
procédés BHC et Boots sont deux méthodes de fabrication de
l'ibuprofène. Le but de cette partie est de comparer ces deux
techniques dans le cadre de la chimie verte.
La
chimie verte.
La chimie verte s'inscrit dans une logique de développement durable et
de recherche permanente de sécurité optimale. Pour
cela les processus mis en jeu doivent éliminer ou au moins réduire
l'utilisation de substances nocives pour l'homme et l'environnement.
Les synthèses chimiques doivent privilégier des méthodes produisant le
minimum de substances dérivées inutiles, surtout si elles sont
polluantes.
Classiquement, pour évaluer l'efficacité d'une synthèse
chimique, on détermine son rendement sans se préoccuper des quantités
de sous-produits formés. Dans le cadre de la chimie verte, pour prendre
en compte la minimisation des quantités de déchets, on définit un
indicateur appelé "utilisation atomique" ( UA). L'utilisation atomique
est définie comme le rapport de lamasse molaire du produit souhaité,
sur la somme des masses molaires de tous les produits.
UA = M(produit souhaité) / S
M(produits).
La conservation de la masse conduit à une autre expression de
cet indicateur :
UA = M(produit souhaité) / S M(réactifs).
Plus cet indicateur UA est proche de 1, plus le procédé est économe en
termes d'utilisation des atomes et moins la synthèse génère de déchets.
Exemple : on synthétise le produit P par réaction entre R et S. Au
cours de la transformation, il se forme aussi les espèces Y et Z selon
l'équation de la réaction :
rR +sS --> P+yY+zZ où r, s, y et z sont les nombres
stoechiométriques.
UA = M(P) / (M(P/ + yM(Y) + zM(Z)) = M(P) / (rM(R) + sM(S)).
|
.
|
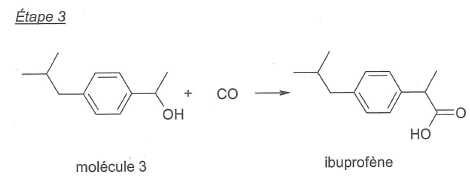
Le
procédé BHC, dont l'utilisation atomique est de 77 %, met en jeu trois
étapes faisant appel à des transformations catalysées :
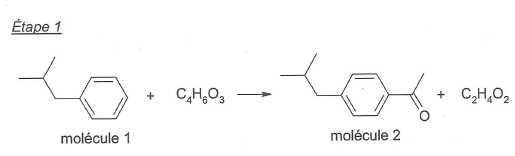
La formule brute de la molécule 2 est C12H16O.
Déterminer
la formule brute de la molécule 1.
La
réaction de l'étape 2 est-elle une substitution, une addition ou une
élimination ? Justifier.
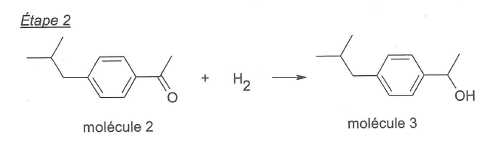
Il
s'agit d'une réduction du groupe carbonyle d'une cétone en alcool
secondaire. Il ne s'agit donc pas d'une substitution.
Une réaction d'élimination conduirait à la formation d'une liaison
multiple supplémentaire. Ce n'est pas le cas ici.
Une réaction d'addition conduit à la suppression d'une
liaison double (C=O) pour la remplacer par une liaison simple.(CH-OH).
L'électronégativité du carbone est inférieure à celle de l'oxygène. Le carbone
de la liaison C=O de la molécule 2 est-il un site donneur ou accepteur
de doublet d'électrons. Justifier.
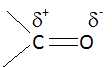
L'atome de carbone est déficitaire en électrons : c'est donc un site
accepteuur de doublet d'électrons.
|
|
Calculer la valeur de l'utilisation
atomique du procédé Boots mettant en jeu six étapes dont le bilan
global est traduit par l'équation de la réaction suivante :
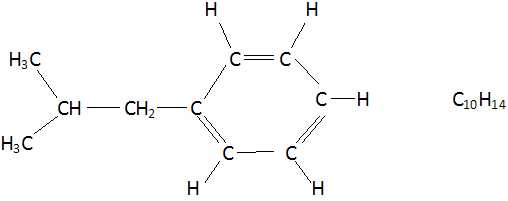
C10H14 + C4H6O3
+C2H5ONa +C4H7ClO2+H3O++NH2OH
+ 2H2O --> C13H18O2
+ sous produits.
| Espèce |
C10H14 |
C4H6O3 |
C2H5ONa |
C4H7ClO2 |
H3O+ |
NH2OH |
2H2O |
Total réactifs |
| M(g/mol) |
134,0 |
102,0 |
68,0 |
122,5 |
19,0 |
33,0 |
36,0 |
514,5 |
M(C13H18O2)
=206,0 g/mol.
Indiquer,
en justifiant, quel est me procédé de synthèse de l'ibuprofène
répondant le mieux à la minimisation des déchets recherchée dans le
cadre de la chimie verte.
UA(procédé
Boots) = 206,0 / 514,5 =0,400 ( 40,0 %).
UA(procédé BHC) =0,77 ( 77 %).
UA(procédé BHC) est le plus proche de 1 que UA(procédé Boots). Le procédé
BHC minimise le mieux les déchets.
|
|