|
|
| L'ibuprofène est une molécule de formule brute C13H18O2.
Son nom en nomenclature officielle est acide
2-(4-isobutylphényl)propanoïque. De part ses propriétés
anti-inflammatoire, antalgique et antipyrétique, elle constitue le
principe actif de divers médicaments. | 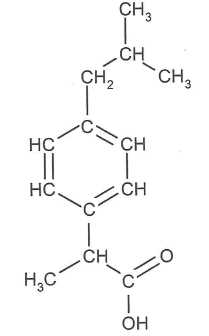 |
La molécule d'ibuprofène.
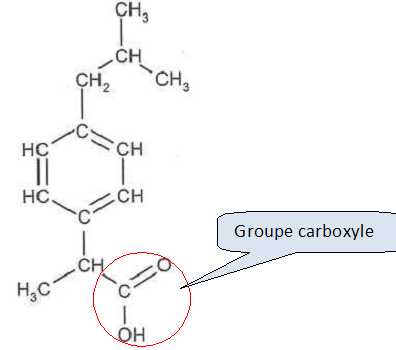
Entourer le groupe caractéristique associé à la fonction acide carboxylique.
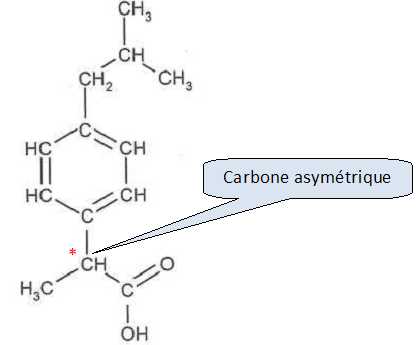
La molécule d'ibuprofène est chirale. Expliquer la cause de cette chilarité en la nommant et en la repérant.
Cette
molécule possède un atome de carbone asymétrique, c'est à dire un atome
de carbone tétragonal lié à 4 atomes ou groupes d'atomes différents.
Une molécule possédant un atome de carbone asymétrique est chirale.
Cette chiralité entraîne l'existence de deux énantiomères de l'ibuprofène. Comment reconnaître si deux molécules sont énantiomères ? ( aucun schéma n'est atendu ).
Une
molécule chirale n'est pas superposable à son image dans un miroir. La
molécule et son image dans un miroir constitue un couple d'énantiomères.
Deux énantiomères sont 2 isomères de configuration, images l'un de l'autre dans un miroir.
Deux énantiomères ne différent que par leur propriétés optiques; ils sont
séparables.
Compléter la représentation de Cram suivante et schématiser le deuxième énantiomère.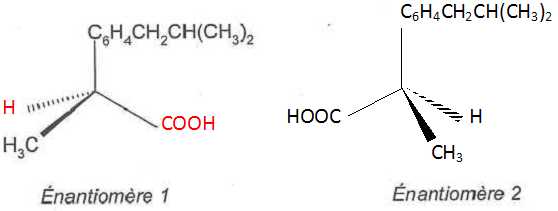 . .
Divers
techniques d'analyse ont permis de connaître la structure de la
molécule d'ibuprofène. Les spectroscopies IR et RMN en sont deux
exemples.
|
.
|
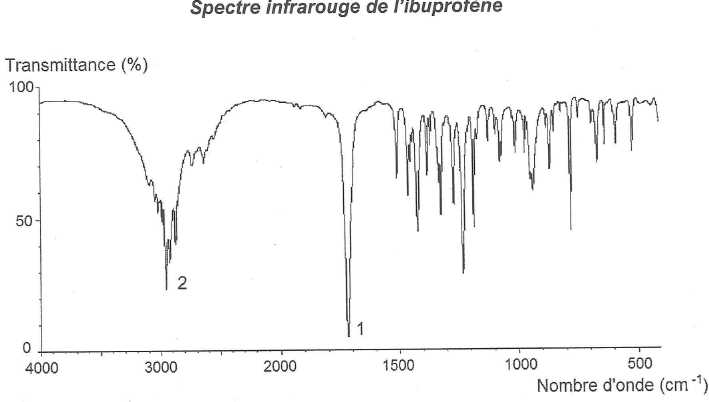
Donner l'origine des bandes d'absorption 1 et 2 du spectre IR.
(1) bande fine et forte vers 1720 cm-1due au groupe C=O de la fonction acide carboxylique.
(2) bande large multipe vers 3000 cm-1 due au liaison C-H et à la liaison O-H associée par liaisons hydrogène.
|
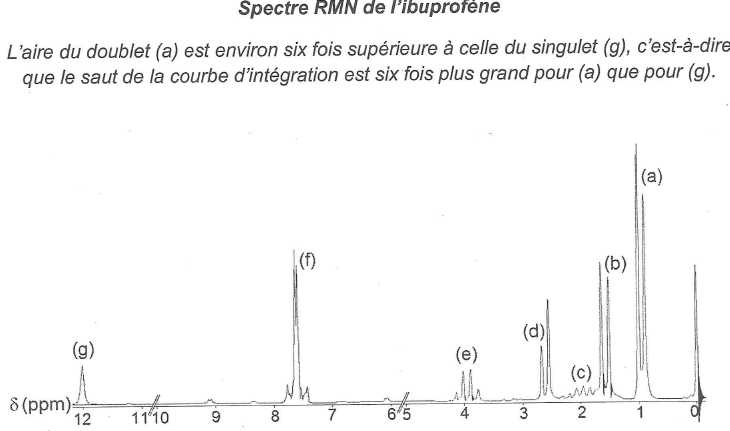
Sur
la formule semi-développée de l'ibuprofène, entourer la ou les atomes
d'hydrogène associés au signal (g) du spectre RMN. Justifier. Expliquer
pourquoi (g) est un singulet. Mêmes questions pour le signal (a). (g) : singulet : ce proton n'est couplé avec aucun autre proton, il n'y a donc aucun "proton proche voisin".
L'aire
du doublet (a) est environ 6 fois plus grande que l'aire du pic (g) :
le signal (g) correspond sans doute à un seul proton. Enfin le
déplacement chimique proche de 12 ppm fait penser au proton d'un acide
carboxylique.
(a) : doublet : ces protons équivalents sont couplés
avec un seul autre proton ( un seul proton "proche voisin"). L'aire du
doublet laisse penser à 6 protons. Enfin le déplacement chimique proche
de 1 ppm est compatible avec deux groupes méthyle CH3. | 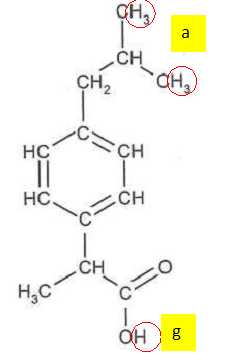 |
|
|