|
|
L'urée ( H2N-CO-NH2 ) réagit avec l'eau pour former de l'ammoniac et du dioxyde de carbone. On réalise deux expériences :
On dissout de l’urée dans de l’eau. Aucune réaction ne semble avoir lieu. Le temps de demi-réaction est estimé à 60 ans.
On dissout de l’urée dans de l’eau en présence d’uréase. Il se
forme quasi-immédiatement lesproduits attendus. Le temps de
demi-réaction vaut 2×10-5 s.
L’uréase, un catalyseur.
Écrire l’équation de la réaction chimique entre l’urée et l’eau.
H2N-CO-NH2 +H2O --> CO2 + 2NH3.
Rappeler la définition du temps de demi-réaction.
Le temps de demi-réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
En quoi les résultats des expériences permettent-ils de considérer l’uréase comme un catalyseur ?
Un catalyseur est un facteur cinétique, il accélère la réaction ( sans catalyseur t½ ~60 ans ; en présence d'uréase t½ = 2 10-5 s).
Effet de la température sur l’activité enzymatique.
Quelle est en général l’influence de la température sur la cinétique d’une réaction chimique ?
La température est un facteur cinétique ; une augmentation de température fait croître la vitesse d'une réaction chimique.
Décrire l’influence de la température sur la cinétique de la réaction catalysée.
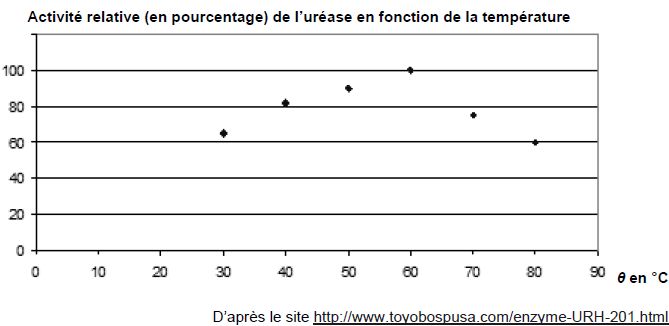
La cinétique de la réaction catalysée est directement liée à l’activité de l’uréase : plus l’activité est grande, plus la réaction est rapide.
L'activité de l'uréase et la vitesse de la réaction sont croissantes jusqu'à une température de 60°C.
L'activité et la vitesse de la réaction est maximale à 60 °C.
L'activité de l'uréase et la vitesse de la réaction diminuent entre 60 et 80°C. jusqu'à une température de 60°C.
Comment peut-on expliquer la différence entre le cas général et celui décrit ?
Les
différentes parties de l'uréase sont liées entre elles notamment par
des liaisons hydrogène qui se forment plus ou moins facilement suivant
la température. Ces liaisons conduisent à la formation d’une
structure tridimensionnelle présentant de nombreux replis. La réaction, que catalyse l’enzyme, se produit
au sein de l’un de ces replis appelé alors site actif.
Le nombre de sites actifs est maximal à 60°C puis diminue ensuite.
|
.
|
L’uréase dans le milieu stomacal.
La bactérie Helicobacter pylori (H.pylori) est responsable de la
plupart des ulcères de l’estomac chez l’Homme. On souhaite savoir
comment elle réussit à survivre dans un milieu très acide, comme
l’estomac, en attendant de rejoindre la muqueuse stomacale où elle
pourra se développer.
Dans la H.pylori, la réaction de production de l’ammoniac à partir de
l’urée se fait selon le processus donné dans la première partie «
Activité enzymatique de l’uréase ».
Le contenu de l’estomac est un milieu très acide qui peut être
considéré comme une solution d’acide chlorhydrique de concentration
1,0×10-2 mol.L-1.
Sachant que l’acide chlorhydrique est un acide fort, calculer le pH de ce milieu.
pH = - log c = - log (1,0 10-2) = 2,0.
À ce pH, quelle espèce chimique du couple NH4+(aq) / NH3(aq) prédomine ? Justifier la réponse.
pKa(NH4+(aq) / NH3(aq)) = 9,2.
A pH inférieur à pKa, la forme acide (NH4+(aq) du couple acide / base prédomine.
La
bactérie utilise son uréase pour catalyser la réaction de l’urée avec
l’eau, ainsi elle sécrète de l’ammoniac dans son environnement proche.
Dans l’estomac, l’ammoniac réagit avec les ions H3O+ selon l’équation chimique :
NH3(aq)+ H3O+(aq) = NH4+(aq) + H2O(l)
Quelle est la conséquence de la sécrétion d’ammoniac par la bactérie sur le pH de la solution autour d’elle ?
La concentration en ion oxonium diminue ( par réaction avec
l'ammoniac )et en conséquene le pH du milieu autour de la bactérie
augmente.
L’enzyme sécrétée par la bactérie H.pylori n’est pas l’uréase seule
mais une association de l’uréase avec d’autres entités chimiques.
En quoi le document ci-dessous illustre-t-il le fait que l’uréase seule ne peut pas agir dans l’estomac ?
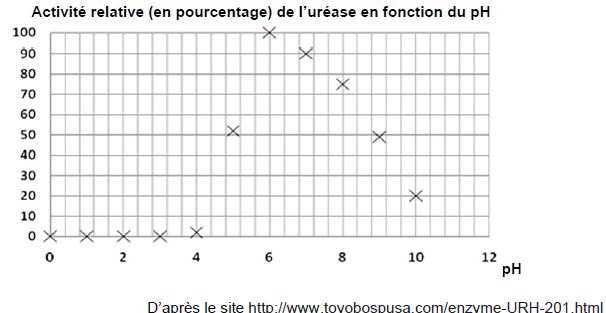
Le pH de l'estomac est proche de 2 ; l'activité relative de l'uréase est nulle à pH inférieur à 4.
L'uréase seule ne peut donc pas jouer son rôle de catalyseur dans l'estomac.
|
|