|
|
La
production industrielle d'acide propanoïque se fait par oxydation du
propaal par le dioxygène.On travaille à une température comprise entre
40 et 50 °C, en présence d'un catalyseur à base de cobalt ou de
manganèse.
Donner
les formules semi-développées du propanal et de l'acide propanoïque.
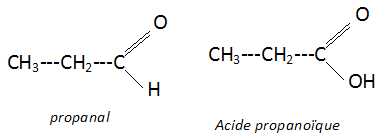
Ecrire
l'équation de la réaction.
CH3-CH2-CHO + ½O2
--> CH3-CH2-COOH.
Le rendement de la réaction est de 90 %.
Donner la
masse de propanal et le volume de dioxygène nécessaires pour produire
une tonne d'acide propanoïque. Vm =
24 L/mol.
M(acide propanoïque) = 3*12+6+2*16 =74 g/mol ; M( propanal) =3*12+6+16
=58 g/mol.
n(acide propanoïque )= 106
/ 74 =1,35 104 mol.
n(propanal ) = n(acide propanoïque )=1,35 104 mol.
masse de propanal : 1,35 104 *58
=7,8 105 g
Prendre en compte le rendement : 7,8 105 /0,9 =
8,7 105 g = 0,87 tonne.
n(dioxygène) = ½n(propanal ) = 0,5 *1,35 104 =6,75
103 mol.
Volume de dioxygène : 6,75 103 *24 = 1,62 105 L =
1,62 102 m3.
Prendre en compte le rendement : 1,62 102 /0,9 =
1,8 102 m3.
L'utilisation atomique ( UA) s'obtient en formant le rapport :
UA = masse d'acide propanoïque formé / S (masses de tous
les réactifs ).
Le facteur E est donné par : UA = 1 / (1+E).
Quelle
est la valeur du facteur E pour cette réaction ?
L'acide propanoïque étant le seul produit, la masse de cet acide est
égale à la somme des masses des réactifs.
par suite UA = 1 et E = 1/UA-1 = 0.
Quelles
sont les trois raisons qui nous permettent de dire que cette réaction
est efficace en terme d'impact sur l'environnement ?
Cette oxydation ne produit pas de dioxyde de carbone, gaz à effet de
serre.
Cette réaction s'effectue vers 50 °C ; il faut brûler peu de
combustibles fossiles pour atteindre cette température.
Un procédé sera donc d'autant plus efficace, que son facteur E sera proche de 0.
|
.
|
On veut
synthétiser, à partir de l'acide propanoïque, le propanamide.
Quelle
est la formule semi-développée du propanamide ? Le spectre UV peut-il
donner des indications sur la structure de cette molécule ?
Le spectre UV d'une molécule possèdant des doubles liaisons conjuguées
présente une bande d'absorption importante. Ce n'est pas le cas ici.
On donne le spectre RMN du propanamide. Attribuer
les 3 pics observés en justifiant.
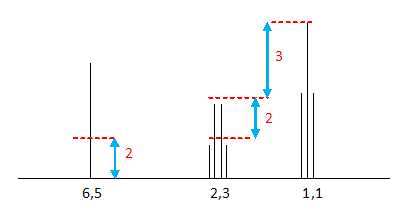
Le singulet à 6,5 ppm correspond aux deux prorons de l'azote.
Le triplet à 1,1 ppm correspond aux 3 protons du méthyle CH3
couplés avec les deux protons du groupe CH2.
Le quadruplet à 2,3 ppm correspond aux deux protons du groupe CH2 couplés
avec les trois protons du méthyle.
Identifier
les principales bandes du spectre IR du propanamide.
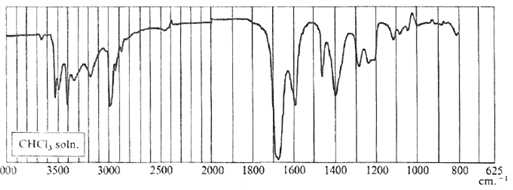
1680 cm-1 : vibration de la liaison CO du
carbonyle CO ; vers 3000 cm-1 : vibration des
liaisons C-H.
Entre 3050 et 3500 cm-1 : 2 bandes de vibrations
des liaisons N-H des amides.
Vers 1200 cm-1 : vibration de la liaison C-N ;
1600 cm-1 : déformation de la liaison
N-H.
Pour effectuer la synthèse du propanamide, on peut penser qu'il suffit
de faire réagir l'ammoniac sur l'acide propanoïque.
Quelle
réaction se produira spontanément en mettant en présence l'acide
propanoïque et l'ammoniac ? Comment se nomme le produit obtenu
?
Réaction acide base : CH3-CH2-COOH
aq + NH3aq --> CH3-CH2-COO-aq
+ NH4+aq ( propanoate
d'ammonium).
Quelle
opération faudrait-il faire ensuite subir au produit obtenu pour
obtenir le propanamide ?
Faire réagir le propanoate d'ammonium sur l'ammoniac.
En réalité, cette réaction est difficile à réaliser, et le rendement
est très mauvais.
|
|
Pour
effectuer la synthèse du propanamide, on peut faire réagir du
chlorure d'ammonium (NH4+
+ Cl-) et du propanoate de sodium (CH3-CH2-COO-
+ Na+).
Après un long chauffage à température élevée, du propanamide se forme,
mais le rendement est très mauvais.
Quelle
masse de chlorure d'ammonium et de propanoate de sodium faut-il faire
réagir pour obtenir 10 g de propanamide si le rendement est 10 %
?
NH4+ + Cl- +
CH3-CH2-COO-
+ Na+--> CH3-CH2-CONH2
+ Na+
+ Cl- + H2O.
M(NH4 Cl) = 14 +4 +35,5
=53,5 g/mol ; M(CH3-CH2-COONa)
=12*3 +5 +2*16+23=96 g/mol ; M(CH3-CH2-CONH2)
=3*12+7+16+14=73 g/mol.
n(propanamide) =10 / 73 =0,137 mol ; n(NH4 Cl)
=n(CH3-CH2-COONa)
=0,137 mol.
m(NH4 Cl) =0,137 *53,5 =7,33 g ; tenir compte du
rendement : 7,33 / 0,10 ~ 73 g.
m(CH3-CH2-COONa)
=0,137 *96 =13,15 g ; tenir compte du rendement : 13,15 / 0,10 ~1,3 102
g.
On peut enfin faire réagir le chlorure de propanoyle sur l'ammoniac.
Dans un erlenmeyer, on mélange 10 mL de chlorure de propanoyle et 30 mL
d'une solution concentrée d'ammoniac. On place l'erlenmeyer
sur un agitateur chauffant ( vers 40 °C ). Au bout d'un quart d'heure,
on refroidit le contenu de l'erlenmeyer dans un bain d'eau glacée. Si
l'amide ne précipite pas, on rajoute un peu d'une solution de soude à 1
mol/L. On filtre sur Büchner, on recristallise et on sèche à l'étuve.
On obtient 7,2 g de propanamide.
Faire
un schéma annoté du dispositif de filtration sur Büchner.
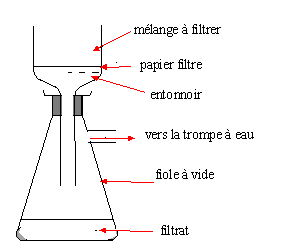
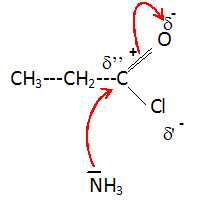
On donne la
formule du chlorure de propanoyle CH3-CH2-COCl. Justifier
que la première étape de la synthèse est une attaque de l'amoniac sur
un site pauvre en électrons.
Les atomes d'oxygène et de chlore sont électronégatifs,
attracteurs d'électrons. L'atome de carbone du carboyle est déficitaire
en électrons.
Ecrire
l'équation de la synthèse en milieu basique.
CH3-CH2-COCl aq + 2 NH3 aq -->CH3-CH2-CONH2 aq
+ NH4+aq + Cl-aq.
La densité
du chlorure de propanoyle est 1,06. L'ammoniac est en excès. Quel est
le rendement de cette synthèse ?
M (CH3-CH2-COCl) = 3*12+5+16+35,5 = 92,5 g/mol
; m(CH3-CH2-COCl ) = 10*1,06 = 10,6 g ; n(CH3-CH2-COCl) =10,6 / 92,5 =0,1146 mol.
M(propanamide) =73 g/mol. ; n(propanamide) = 0,1146 mol ; m = 0,1146*73
=8,4 g.
Rendement : 7,2 / 8,4 = 0,86 ( 86 % ).
|
|





