|
|
La
composition de la gousse de vanille est très riche en arômes dont le
principal est la vanilline. Du fait de son coût d'extraction élevé, on
lui préfère la vanilline de synthèse ou encore éthylvanilline qui a un
pouvoir arômatisant 2 à 4 fois plus grand.
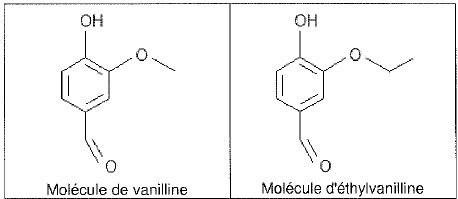
La molécule de vanilline.
Cette molécule possède-t-elle un atome de carbone asymétrique ? Justifier.
Un
atome de carbone asymétrique est tétragonal et est lié à 4 atomes ou
groupes d'atomes différents. La molécule de vanilline ne possède pas
d'atome de carbone asymétrique.
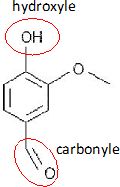
Entourer et nommer deux groupes caractéristiques de cette molécule.
Indiquer en justifiant brièvement si les propositions suivantes sont vraies ou fausses.
Les molécules de vanilline et d'éthylvanilline sont isomères. Faux.
Elles n'ont pas la même formule brute.
Les molécules de vanilline et d'éthylvanilline sont chirales. Faux.
Elles ne possèdent pas d'atome de carbone asymétrique.
Dosage spectrophotométrique de la vanilline contenu dans un extrait de vanille acheté dans le commerce.
La vanilline contenue dans l'échantillon ( solution aqueuse sucrée ) est extraite par du dichlorométhane.
Un traitement basique permet ensuite de faire passer la vanilline en solution aqueuse sous forme d'ion phénolate.
On réalise ensuite un dosage par étalonnage de cet ion par
spectrophotométrie UV-visible afin de déterminer la concentration en
vanilline de l'échantillon.
Etape 1 : extraction et passage en solution basique.
A 1,0 mL d'échantillon on ajoute 10 mL d'eau distillée.
On procède à trois extractions successives en utilisant à chaque fois 20 mL de dichlorométhane.
A partir de la phase organique on extrait 3 fois la vanilline avec 50
mL d'une solution aqueuse d'hydroxyde de sodium de concentration 0,1
mol/L. On rassemble les phases aqueuses.
Etape 2 : préparation de la solution à doser et mesure de son absorbance.
On introduit les phases aqueuses précédentes dans une fiole jaugée de
250 mL et on complète jusqu'au trait de jauge avec la solution
d'hydroxyde de sodium précédente. La mesure de l'absorbance donne A =
0,88.
Etape 3 : préparation d'une gamme étalon.
A partir de la solution mère de vanilline, on prépare par dilution dans
une solution aqueuse d'hydroxyde de sodium de concentration 0,1 mol/L
des solutions filles et on mesure leur absorbance.
Solution fille
|
S1
|
S2
|
S3
|
S4
|
S5
|
Concentration en vanilline ( mol/L)
|
5,0 10-5
|
4,0 10-5
|
3,0 10-5
|
2,0 10-5
|
1,0 10-5
|
Absorbance
|
1,36
|
1,08
|
0,81
|
0,54
|
0,27
|
|
.
|
On donne : dichlorométhane : d = 1,33, non miscible à l'eau.
Vanilline C8H8O3 : soluble dans la plupart des solvants organiques, peu soluble dans l'eau. M = 152 g/mol.
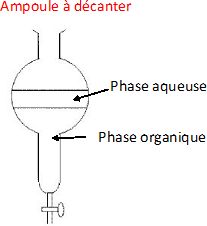
Lors de l'extraction par le dichlorométhane de la vanilline, indiquer
le nom de l'instrument de verrerie utilisé et justifier la position de
la phase dans laquelle se trouve la vanilline en fin d'extraction.
Dans l'ampoule à décanter, la vanilline se trouve dans le
dichlorométhane, solvant où elle est très soluble. Le dichlorométhane
ayant une densité supérieure à celle de l'eau occupe la partie
inférieure.
L'équation de la réaction de la vanilline avec les ions hydroxyde s'écrit :
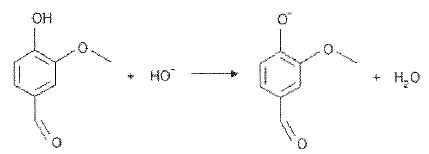
La vanilline est-elle un acide ou une base ? Justifier.
La vanilline cède un proton H+ à l'ion hydroxyde. La vanilline joue le rôle d'acide.
On donne le spectre d'absorption UV-visible de l'ion phénolate.
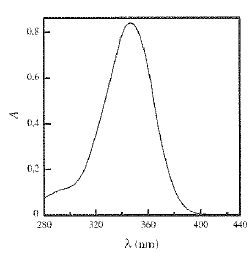
Cet ion absorbe-t-il dans le domaine visible ? Justifier.
Le
maximum d'absorption se situe entre 320 et 380 nm. Or le domaine
visible s'étend de 400 à 800 nm. Cet ion absorbe donc dans le proche UV.
Les solutions basiques de vanilline sont-elles colorées ? Justifier.
L'ion phénolate possède 4 doubles liaisons conjuguées auquel il faut ajouter un doublet électronique porté par l'oxygène.
Or en l'absence de groupe caractéristique, il faut au moins 7 liaisons
conjuguées pour obtenir une molécule colorée. La vanilline en solution
basique est incolore.
|
Tracer la courbe d'étalonnage A = f(c). La loi de Beer est-elle vérifiée ?
La courbe est une droite passant par l'origine : la loi de Beer est vérifiée.
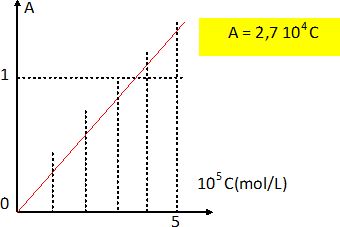
Calculer la concentration en g/L de la vanilline dans l'échantillon de vanille liquide du commerce.
La concentration de la vanilline est égale à celle de l'ion phénolate.
C = 0,88 / (2,7 104) =3,26 10-5 mol/L.
Tenir compte de la dilution :
A 1,0 mL d'échantillon on ajoute 10 mL d'eau distillée.
On
introduit les phases aqueuses précédentes dans une fiole jaugée de 250
mL et on complète jusqu'au trait de jauge avec la solution d'hydroxyde
de sodium précédente.
Facteur de dilution =250.
Concentration de la vanilline avant dilution : 3,26 10-5*250 =8,15 10-3 mol/L.
8,15 10-3 *152 =1,2 g/L.
|
|