|
|
Lorsque
es pommes mûrissent, leurs membranes cellulaires s'oxydent, engendrant
la dégradation des acides gras à longues chaînes qu'elles contiennent.
Il en résulte la formation de deux molécules A et B.
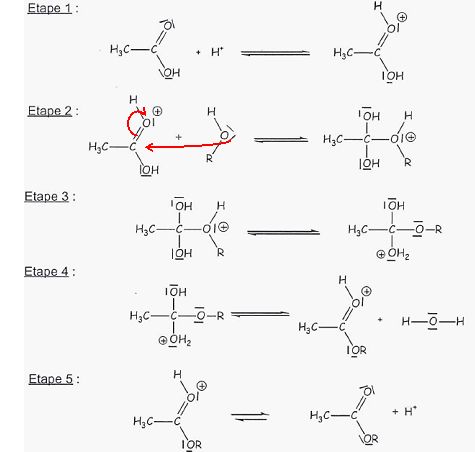
Donner le nom de la fonction chimique présente dans les molécules A et B.
Fonction ester.
Laquelle de ces molécules se nomme éthanoate de 3-méthylbutyle ? Justifier.
La première partie du nom d'un ester provient de l'acide carboxylique : acide éthanoïque.
La seconde partie est issue de l'alcool : 3-méthylbutan-1-ol.
A : éthanoate de 3-méthyl-butyle ( B : 2-méthylbutanoate d'éthyle ).
Préciser la formule brute de A et B. En déduire par quelle relation les molécules A et B sont liées.
C7H14O2 : A et B sont des isomères.
La molécule A présente-t-elle un ( ou des) carbones asymétriques ? Si oui, le ( ou les ) matérialiser à l'aide d'un astérisque *.
La
molécule A ne possède pas de carbone tétraèdrique lié à 4 atomes ou
groupes d'atomes différents : A ne possède pas de carbone asymétrique.
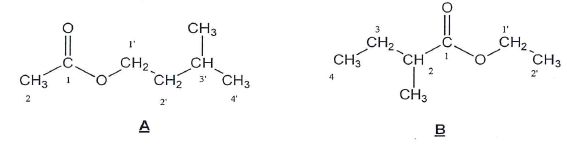
Le composé B présente deux stéréoisomères.
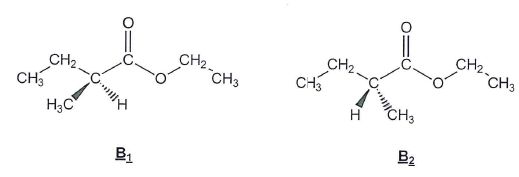
Donner le nom du type de stéréoisomérie de configuration qui lie B1 et B2.
Ce sont des énantiomères, image l'un de l'autre dans un miroir.
On souhaite séparer par distillation fractionnée un mélange de composés B1, B2 et A.
Températures d'ébullition respectives : 133 °C ; 133°C et 142°C sous 1 bar.
Annoter le schéma de distillation fractionnée.
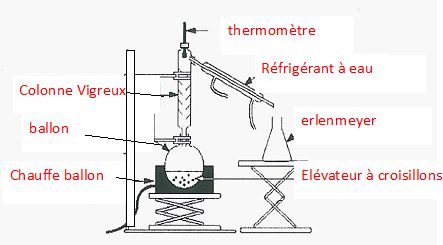
Dire
si une séparation est possible. En cas d'affirmative, quel est l'ordre
dans lequel on recueille les composés dans le distillat.
B1 et B2, ayant la même température d'ébullition, ne sont pas séparables par distillation fractionnée.
A et le mélange B1+B2 peuvent être séparés par cette méthode.
B1+B2 espèces les plus volatils distillent en premier. A, moins volatil, est recueilli ensuite.
|
.
|
On donne deux spectres RMN du proton correspondant aux molécules A et B.
Donner
la multiplicité des hydrogènes proches des groupements -COO- des
molécules A et B. Associer les spectres 1 et 2 aux molécules A et B.
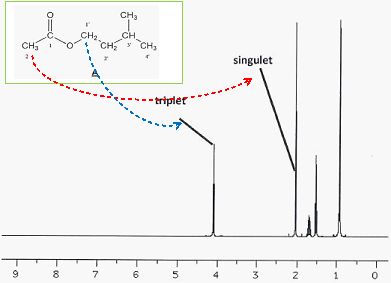
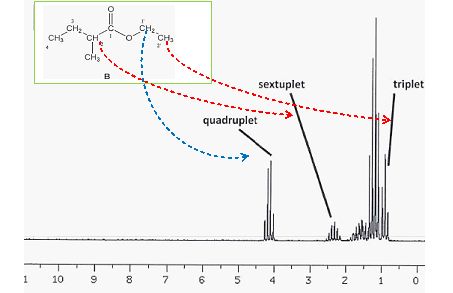
.
|
Synthèse de A.
Introduire dans un ballon 20,0 mL de 3-méthylbutan-1-ol, puis 30,0 mL
d'acide éthanoïque pur et environ 1 mL d'acide sulfurique concentré.
Ajouter trois grains de pierre ponce, adapter le réfrigérant à boules et chauffer à reflux pendant 30 minutes.
Extraction de A.
Après refroidissement, verser dans le ballon environ 50 mL d'une
solution d'eau froide saturée de chlorure de sodium et transvaser le
mélange dans une ampoule à décanter.
Agiter, décanter et éliminer la phase aqueuse.
Ajouter 50 mL d'une solution à 5% d'hydrogénocarbonate de sodium.
Agiter l'ampoule jusqu'à ce qu'il n'y ait plus d'effervescence.
Décanter et éliminer la phase aqueuse.
Recueillir la phase organique dans un erlenmeyer et ajouter une spatule de sulfate de magnésium anhydre.
Agiter puis filtrer sur éprouvette graduée. On obtient un volume V = 18,1 mL de A.
Donner le nom et la formule du produit manquant dans l'équation. eau.
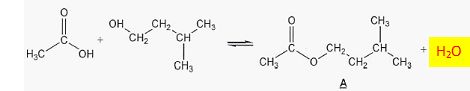
Quel est le rôle de l'acide sulfurique ?
Catalyseur.
Lors
de la première décantation, dans quelle phase se trouvent
essentiellement la molécule A, les ions, le 3-méthylbutan-1-ol qui n'a
pas réagi et l'acide éthanoïque en excès ? Quelle est la phase située
au dessus ? Justifier.
Les ions, l'acide éthanoïque en excès, molécule polaire, se trouvent dans la phase aqueuse.
A et le 3-méthylbutan-1-ol, très peu solubles dans l'eau saturée de chlorure de sodium constituent la phase organique.
A et le 3-méthylbutan-1-ol, ayant des densités inférieures à celle de l'eau salée se trouve donc au dessus de la phase aqueuse.
Préciser
la nature de l'effervescence observée lors de l'ajout
d'hydrogénocarbonate de sodium et écrire l'équation de la réaction
acide base mis en jeu.
Dégagement de dioxyde de carbone.
HCO3-aq + H3O+aq ---> CO2(g) + 2H2O(l).
Calcul du rendement.
Calculer les quantités de matière d'acide éthanoïque et de 3-méthylbutan-1-ol introduites dan le ballon.
Densité de l'acide étanoïque : 1,05 ; du 3-méthylbutan-1-ol : 0,81; de A : 0,87.
Masse molaire ( g/mol) : acide éthanoïque 60 ; 3-méthylbutan-1-ol : 88 ; de A : 130.
n(acide éthanoïque) = 30,0 *1,05 / 60=0,525 ~0,53 mol.
n(3-méthylbutan-1-ol) =20,0 *0,81 / 88 = 0,184 ~0,18 mol ( en défaut ).
En déduire le rendement de cette synthèse.
n(A théorique) = 0,184 mol soit : 0,184*130 =23,9 g.
Masse réelle de A : 18,1*0,87 = 15,7 g. Rendement : 15,7 / 23,9 ~0,66 ( 66 %).
|
|