|
Pile, électrolyse, chimie organique : concours kiné St Michel 2012. |
||||||
|
||||||
|
Choisir
la ou les réponse(s) exacte(s).
Pile. Electrolyse. Cinétique.
Chimie organique. A) Un hydrocarbure est une molécule organique composée uniquement de carbone et d'hydrogène. Vrai. B) Dans la molécule d'éthène, les atomes de carbone ont un environnement tétraèdrique. Faux. Les atomes de carbone sont trigonaux. C) La molécule de hex-3-ène présentez une isomérie Z/E. Vrai. 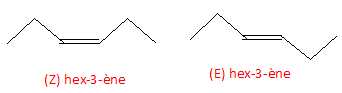 D) Le test à la DNPH permet de distinguer un aldehyde d'une cétone. Faux. Ce test est positif avec le groupe carbonyle d'un aldehyde et d'une cétone. Chimie organique. A) Le 2,3-diméthylpentane est un isomère du 2-méthylhexane. Vrai. Ils ont la même formule brute C7H16 et des structures différentes. B) Les alcools ont pour groupe caractéristique le groupe hydroxyle. Vrai. C) Une molécule qui subit une opération de reformage voit son nombre d'atomes de carbone diminuer. Faux. Le nombre d'atomes de carbone ne change pas. D) Un cycloalcane a même formule brute qu'un alcène. Vrai. CnH2n.
|
||||||
|
|