|
|
L'hypochlorite de sodium est utilisé depuis des décennies pour désinfecter l'eau. Ce produit peut être fabriqué
par électrolyse d'une solution aqueuse de chlorure de sodium.
Données :
Quelques couples oxydant/réducteur : H2O(l) / H2(g) ; Cl2(g) /Cl-aq ; O2(g) / H2O(l) ; ClO-aq/ Cl2(g).
On prendra: NA.e : 1,0,105 C.mol-1, avec NA constanted'Avogadro et e : charge élémentaire.
Électrolyse d'une solution aqueuse de chlorure de sodium.
Un tube en U contient une solution aqueuse de chlorure de sodium Na+aq + Cl-aq.
Deux électrodes A et B trempent dans la solution, et sont reliées aux bornes d'un générateur de tension continue G.
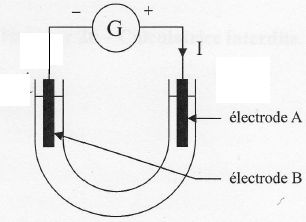
Après plusieurs minutes de fonctionnement, on effectue des tests d'identification des produits formés :
- à une électrode, il s'estformé un dégagement de dichlore.
- à l'autre électrode, il s'est formé un dégagement de dihydrogène et il est apparu en solution des ions hydroxyde HO-.
L'équation de la réaction modélisant l'électrolyse est :
2 H2O (l) + 2 Cl-aq = H2(g) +Cl2(g) + 2HO-aq (1).
À partir des indications de l'énoncé, identifier les deux couples oxydant/réducteur mis en jeu dans l'équation 1 modélisant l'électrolyse.
H2O(l) / H2(g) ; Cl2(g) /Cl-aq.
En déduire quelle est l'espèce chimique qui est oxydée au cours de l'électrolyse.
2Cl-aq = Cl2(g) + 2e- : oxydation des ions chlorure.
Identifier l'électrode (A ou B) à laquelle se produit I'oxydation. Quel gaz se dégage à cette électrode ?
Une oxydation se produit à l'anode positive A : le dichlore se dégage à l'anode.
Le générateur délivre une tension continue d'environ 20 V. L'intensité du courant vaut I : 10 A.
Etablir un tableau d'avancement relatif à la transformation modélisée par l'équation 1.
|
avancement (mol)
|
2 H2O (l) |
+ 2 Cl-aq |
= H2(g) |
+Cl2(g) |
+ 2HO-aq |
initial
|
0
|
solvant
en large
excès
|
n0
|
0
|
0
|
0
|
en cours
|
x
|
n0-2x
|
x
|
x
|
2x
|
fin
|
xmax
|
n0-2xmax |
xmax |
xmax |
2xmax |
En déduire la relation entre la quantité n(e), en mole, d'électrons échangés et la quantité n(Cl2(g)) de dichlore formé lors de la réaction d'équation 1.
2Cl-aq = Cl2(g) + 2e- ;
n(e ) = 2n( Cl2(g)).
|
