|
|
L'aluminium
est obtenu par électrolyse de l'alumine dissoute dans la cryolite
fondue à 950 °C. Une unité de production est formée de 250 cellules
électrolytiques branchées en série sous une tension de 1000 V. Elles
sont parcourues par un courant d'intensité I = 300 kA. La fcem
d'une cellule est de 2, 8 V.
La fabrication d'une tonne d'aluminium nécessite 2 t d'alumine et une énergie de 12 MWh.
Calculer
la puissance électrique mise en jeu par une unité de production.
12 MWh : puissance fournie pendant une heure.
P =UI =1000* 3,0 105 = 3,0 108 W = 300 MW.
Calculer
la tension aux bornes de chaque cellule électrolytique.
Additivité des tensions aux bornes d'appareils montés en série.
1000 /250 = 4,0 V.
Calculer la puissance perdue par effet joule.
U = E'+r'I ; r' = (U-E) / I = (4-2,8) / 3,0 105 = 4 10-6 ohm.
Soit pour 250 cellules en srie : 250*4 10-6 = 1,0 10-3 ohm.
Pjoule = r'I2 =1,0 10-3 *(3,0 105)2 = 9,0 107 W = 90 MW.
Autre méthode : Puissance utile = 250 E I = 250*2,8 *3,0 105=2,1 108 W = 210 MW.
Pjoule = 300-210 = 90 MW.
En déduire la puissance électrique transformée en puissance chimique.
Puissance utile =210 MW.
Calculer la durée nécessaire pour élaborer une tonne d'aluminium.
énergie (MWh) / puissance (MW) = 12 / 300 = 0,04 h = 144 s.
|
.
L'aluminium
est tiré de l'alumine par réduction électrolytique qui s'effectue dans
une cuve que traverse un courant continu à haute intensité ( de l'ordre
de 105 A sous une tension de 4 V ).
Les cuves sont
revétues de blocs de carbone qui forme la cathode. Les cuves
contiennent un électrolyte en fusion qui dissout l'alumine Al2O3(s)
qui y est apporté. Les anodes, constituées de carbone très pur,
plongent dans l'électrolyte. Par électrolyse à 950 °C, l'alumine est
transformée en aluminium et en oxygène. L'aluminium liquide se dépose
au fond de la cuve, oùil est récupéré puis solidifié après
refroidissement.
Réaction de dissolution de l'alumine : Al2O3(s) ---> 2Al3+ + 3 O2-.
Couples mis en jeu : Al3+/ Al(s) ; O2(g) /O2- .
Réaction d'éllectrolyse de l'alumine : 4Al3+ + 6 O2----> 4 Al(s) + 3O2(g).
Quel est l'action de l'électrolyte sur l'alumine introduite ?
L'électrolyte
permet d'obtenir l'alumine liquide à une température assez basse, 950
°C, alors que la température de fusion de l'alumine pure est bien
supérieure.
Faire
un schéma simplifié du circuit électrique montrant la cuve, la
position et le nom des électrodes, l'électrolyte , le générateur en
précisant la polarité des bornes.
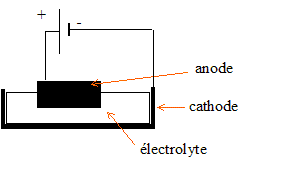
Ecrire les équations des réactions se produisant à lanode et à la cathode.
Réduction à la cathode : Al3+ + 3e- = Al(s).
Oxydation à l'anode : 2O2- = O2(g) +4e-.
Durée de fonctionnement de
l'électrolyseur.
On cherche la durée nécessaire D
t pour préparer, par électrolyse,
une masse m d'aluminium, l'intensité du courant I
étant constante.
Donner l'expression littérale de la quantité
d'électrons nécessaire à la
production de la masse m d'aluminium.
La quantité de matière
d'électrons (mol) est trois fois plus grande que la
quantité de matière d'aluminium (mol) :
n = 3 m/M(Al) = 3m / 27 = m/9 avec m en gramme.
Donner l'expression littérale de la
quantité d'électricité Q
consommée par l'électrolyseur.
Q = nF avec F, le faraday ( 96500 C) ; Q = m F / 9 = 96500/9 m = 1,072 104 m.
- La masse m d'aluminium fabriqué est m = 1,08
tonnes et l'intensité du courant I de 1,0
105 A. Aide au calcul : 1,08 / 27,0 = 4,00
10 -2
En déduire l'ordre de grandeur de la
durée Dt en heures de
l'électrolyse. m = 1,08 t ; I = 1,0 105 A.
Q = I Dt = 1,072 104 m. Dt = 1,072 104 m / I = 1,072 104 *1,08 106 / 1,0 105 = 1,16 105 s ~ 32 h.
|
|
