|
Electrolyse : traitement d'effluents : concours technicien supérieur de l'industrie et des mines 2011. |
||||||
|
||||||
|
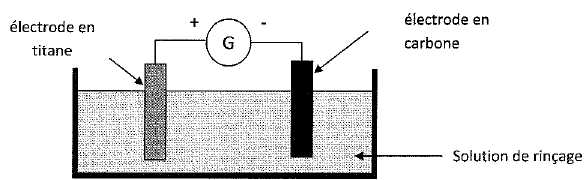
On s'intéresse à une technique électrochimique qui vise à respecter la teneur officielle en cuivre dissous dans les effluents qui résultent des opérations de rinçage. Le second rinçage s'effectue en circuit fermé. Les eaux de rinçage sont envoyées sur des cellules d'électrodéposition fonctionnant en continu, qui permettent de réutiliser ces eaux. La cuve d'électrodéposition contient une électrode en titane et une électrode en carbone. Ces deux électrodes sont immergées dans la solution de rinçage et sont alimentées par un générateur de courant continu.
n(e-) = 2 nCu =2*4,110 = 8,220 ~8,2 mol. Exprimer la quantité d'électricité Q utilisée par la cellule durant l'opération. Q = n(e-) F ave F le faraday ( 96500 C). Exprimer puis calculer l'intensité du courant I supposée constante. Q = I Dt ; I = n(e-) F / Dt = 8,220 *96500 /(6*3600) =3,67 ~3,7 A.
Intérêt du procédé. Dans l'installation industrielle, deux appareils montés en parallèle sur le circuit des eaux de rinçage assurent cette fonction d'élimination des ions Cu2+. Cela permet, par un dispositif annexe contenant un jeu d'électrodes supplémentaire, de récupérer le dépôt de cuivre solide tout en permettant à l'unité de traitement de fonctionner sans interruption. Une méthode plus classique consiste à précipiter les ions Cu2+aq présents dans les eaux de rinçage sous forme d'hydroxyde de cuivre (II), par ajout d'une solution d'hydroxyde de sodium ( Na+aq + HO-aq). La réaction est alors : Cu2+aq + 2 HO-aq= Cu(OH)2(s). Calculer la masse de précipité d'hydroxyde de cuivre obtenu lors de la précipitation de 4,11 mol d'ion cuivre (II) et la comparer avec la masse de cuivre obtenue précédemment. Il se forme = 4,11 mol d'hydroxyde de cuivre (II) ; M(Cu(OH)2) = 63,5 +2*17 =97,5 g/mol. m = 4,11 *97,5 ~401 g, environ 1,5 fois la masse de cuivre déposée à la cathode. Ce résultat nous permet d'établir une comparaison des deux procédés ( électrodéposition et précipitation ) sur la base des produits obtenus dans chaque cas. Quel est le produit obtenu qu'il faudra extraire des eaux de rinçage, puis traiter chimiquement pour le recycler ? Il faut exttraire l'hydroxyde de cuivre (II) solide par filtration. Lequel des deux procédés donne un produit directement utilisable ? L'électrodéposition donne du cuivre métallique directement utilisable.
|
||||||
|
|