|
|
La magnésite.
Un des minerais contenant l'élément magnésium est la
magnésite de formule brute MgCO3. l'élément magnésium
possède trois isotopes 2412Mg, 2512Mg, 2612Mg.
Donner
la composition du noyau de l'isotope 2512Mg.
12 protons et 25-12 = 13 neutrons.
Donner la structure
électronique de l'élément magnésium.
1s2 2s2 2p6 s2.
En
déduire la formule de l'ion que peut donner l'élément magnésium.
Justifier.
Mg2+ : 1s2
2s2 2p6.
La couche électronique externe de cet ion est complète à huit électrons
( règle de l'octet ).
En
déduire la formule de l'ion carbonate. Justifier.
Un solide ionique est électriquement neutre : Mg2+ + CO32-.
Pétrochimie.
On traite une tonne de gasoil moyen par craquage électrolytique. Il est
transformé en gasoil léger ( 20 %), en naphta ( 15 %) et en essence (65
% en masse ). Le craquage de ces coupes ( gasoil lèger et naphta)
permet d'obtenir les produits suivants : dihydrogène, méthane,
éthylène, propylène... dont les pourcentages en masse sont donnés dans
le tableau suivant :
|
gasoil
léger
|
naphta
|
dihydrogène
|
1,5
|
0,9
|
méthane
|
17,5
|
11,2
|
éthylène
|
33,6
|
26,0
|
propène
|
15,6
|
16,1
|
butadiène
|
4,5
|
4,5
|
benzène
|
11,9
|
11,1
|
autres
C4 - C8
|
10,7
|
12,1
|
fuel
|
4,7
|
18,1
|
Donner
les formules semi-développées du méthane et du propène.
CH4 ; CH3--CH=CH2.
Déterminer
les masses de naphta et de gasoil léger obtenues à partir d'une tonne
de gasoil moyen.
mgasoil = 1,0*0,20 = 0,20 t : mnaphta = 1,0 *0,15
= 0,15 t.
En
déduire la masse d'éthylène obtenue.
0,336 mgasoil +0,26 mnaphta =0,336*200 +0,26*150 =67,2 +39
=106,2 kg
|
Le benzène obtenu sert à
fabriquer le styrène C6H5-CH=CH2. Pour
cela on fait réagir le benzène C6H6 avec
l'éthylène, il se forme de l'éthylbenzène que l'on déshydrogène en
styrène.
Ecrire
les équations des réactions chimiques correspondantes.
C6H6
+CH2=CH2 ---> C6H5-CH2-CH3.
C6H5-CH2-CH3
---> C6H5-CH=CH2 + H2.
Ecrire l'équation de
la réaction de polymérisation du styrène permettant d'obtenir le
polystyrène.
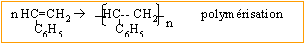
Métallurgie du
chrome.
Le chrome est obtenu par aluminothermie : on réduit l'oxyde de chrome Cr2O3
par l'aluminium et on obtient le métal chrome et l'alumine.
Cr2O3 (s) + 2Al(s) = Al2O3 (s)
+ 2Cr(s).
La production mondiale actuelle
est de l'ordre de m =17 000 tonnes de chrome par ce procédé.
Déterminer la
quantité de matière de chrome correspondante. M(Cr) = 52,0 g/mol.
n Cr = m / M(Cr) = 17000 106 / 52 =3,26923 108
~ 3,27 108 mol.
En
déduire la quantité de matière d'aluminium nécessaire ainsi que la
quantité de matière d'alumine formée annuellement.
nalumine = ½n Cr ; nAl =nCr.
En
déduire la masse d'aluminium nécessaire. M(Al) = 27,0 g/mol
nAl M(Al)=3,26923 108 *27,0 =8,83 109
g = 8,83 103 t.
Quelle
est la masse d'alumine produite. M(alumine) = 2*27+3*16 =102
g/mol
nalumine M(alumine)= 0,5 * 3,26923 108*102 =1,67
1010 g =1,67 104 t.
Titrage d'une
eau polluée.
Ecrire l'équation de la réaction entre une solution d'acide chlorhydrique ( H3O+ + Cl-) et une solution d'hydroxyde de sodium ( Na+ + HO-).
H3O+ aq + HO- aq---> 2H2O(l).
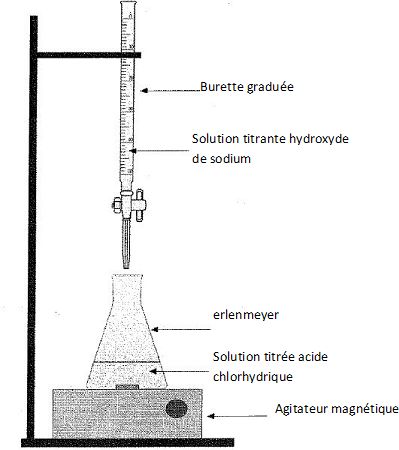
Compléter le schéma du dispositif utilisé pour le titrage.
Comment repère t-on l'équivalence ?
Changement de couleur d'un indicateur colorée, BBT par exemple.
On traite un volume Va = 200 mL d'eau polluée par une solution d'hydroxyde de sodium de concentration CB = 1,00 10-2 mol/L. le volume équivalent vaut Véq = 18,0 mL.
Calculer la concentration en ion oxonium de l'eau polluée.
A l'équivalence : [H3O+ aq] Va =CB Véq ; [H3O+ aq] =CB Véq / Va = 1,00 10-2 *18,0 / 200 = 9,00 10-4 mol/L.
En déduire le pH de l'eau polluée et commenter.
pH = - log[H3O+ aq] =-log(9,00 10-4) = 3,0. L'eau est trop acide, il faut ramener le pH vers 7 avant de la rejeter dans la nature.
En déduire la masse d'hydroxyde de calcium qu'il faut ajouter à 1 m3 d'eau polluée pour ramener son pH à 6,2.
M(Ca(OH)2) = 40,1 + 2*17 =74,1 g/mol.
Quantité de matière initiale d'ion oxonium : 9,00 10-4 *1000 = 0,900 mol.
Quantité de matière finale d'ion oxonium : 10-6,2 *1000 = 6,31 10-4 mol.
Quantité de matière d'ion oxonium ayant réagi : 0,900 -6,31 10-4 =0,89937 mol.
2H3O+ aq+ Ca(OH)2(s) = Ca2+aq + 4H2O(l).
n(Ca(OH)2(s)) =½n(H3O+ aq) = 0,5 *0,89937 =0,4497 mol.
Masse d'hydroxyde de calcium = 0,4497 *74,1 =33,3 g.
|
|
