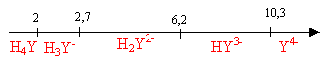|
.
|
|
Nous
nous proposons d’étudier dans ce problème la réaction de complexation
des ions Chrome (III) par l’EDTA (Acide Ethylène Diamine TétrAcétique
symbolisé par Y4-), en solution aqueuse tampon à pH = 4.
L’EDTA est introduit sous la forme de l’espèce H2Y2-.
pKa1
(H4Y/H3Y-) = 2,0 ;
pKa2
(H3Y-/H2Y2-) =
2,7 ; pKa3
(H2Y2-/HY3-) = 6,2 ;
pKa4 (HY3-/Y4-) = 10,3.
Etude des équilibres acido-basiques du ligand Y4- :
Donnez les expressions littérales des constantes Ka4 et Ka3.
Ka3 associé à l'équilibre
acide base H2Y2-+
H2O=HY3-+ H3O+ :
Ka3 =
[HY3-][H3O+]
/ [H2Y2-]
(1)
Ka4 associé à l'équilibre
acide base HY3- + H2O=Y4-+
H3O+ : Ka4 =
[Y4-][H3O+]
/ [HY3-] (2)
En déduire le rapport des concentrations [Y4-] / [H2Y2-] en fonction des constantes d’acidité et de la concentration en [H3O+].
Ka3 Ka4 =[Y4-][H3O+]2 / [H2Y2-]
[Y4-] / [H2Y2-] = Ka3 Ka4 / [H3O+]2.
Montrez qu’à pH tampon = 4 la quantité de Y4- est négligeable devant celle de H2Y2-.
[Y4-] / [H2Y2-] = 10-6,2 * 10-10,3 / 10-8 = 10-8,5 ~3,2 10-9.
Représentez
sur une échelle de pH les domaines de prédominance des espèces
acido-basiques de l’EDTA en fonction du pH. Quelle est l’espèce
prédominante à pH = 4 ?
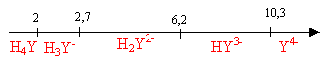
à
pH=4 , H2Y2-
prédomine.
Etude de la réaction de complexation :
Dans le domaine de pH de prédominance de l’espèce H2Y2- à la concentration de 0,4 mol.L-1 on introduit des ions Cr3+ à la concentration de 1,2 10-2 mol.L-1. On admettra qu’à ce pH la concentration de l’espèce Y4- reste constante, égale à 2,0 10-7 mol.L-1 tout au long de la réaction de complexation.
Constante de dissociation de l’ion complexe [CrY]- : KD = 1,0 . 10-23.
Constante de formation de l’ion complexe [CrY]- : β = 1,0 . 1023.
Donnez l’expression de la constante de dissociation ou de la constante de formation du complexe [CrY]-.
[CrY]- = Y4- + Cr3+
constante associée KD
=[Cr3+][Y4-] /
[[CrY]-] =
10-23.
|
.
Exprimez le rapport des concentrations [[CrY]-] / [Cr3+] en solution. Que pouvez vous en conclure ?
Appliquez la règle de conservation des espèces à l’élément chrome
présent en solution. Calculez la concentration des ions Cr3+ à
l’équilibre.
[Y4-] =2,0 10-7 mol/L ;
[Cr3+]*2,0 10-7 /
[[CrY]-] = 10-23
; [Cr3+] /
[[CrY]-] =10-23
/ (2 10-7 )= 5 10-17.
[[CrY]-]
=[Cr3+] /5 10-17 = 2
1016 [Cr3+].
Conservation de l'élément chrome :
[Cr3+] +
[[CrY]-] = 1,2 10-2
=[Cr3+] + 2 1016
[Cr3+] d'où [Cr3+] = 6
10-19 mol/L.
Donc la réaction de complexation est totale (
pratiquement tous les ions chrome (III) ont disparu de la
solution).
Etude cinétique de la réaction de complexation :
A pH=4,l’équation de la réaction de complexation s’écrit : Cr3+ + H2Y2- =
[CrY]- + 2 H+ .
On suppose que la vitesse de cette réaction suit la loi de vitesse des
réactions chimiques élémentaires ou loi de Van't Hoff . L’ordre partiel
sera donc de 1 par rapport aux ions Cr3+ mais
aussi 1 par rapport à H2Y2-. On appellera k la constante de vitesse de la réaction.
Initialement, la solution contient C0 = [Cr3+]0 = 1,2 10-2 mol.L-1 d’ions Cr3+ et [H2Y2-]0 =0,400 mol.L-1.
On suit le déroulement de la réaction, à température, volume et pH
constants, de façon à déterminer la concentration en ions Cr3+ non complexés (notée C) en fonction du temps écoulé t :
t(min)
|
0
|
10
|
20
|
30
|
40
|
60
|
90
|
120
|
C (mol/L)
|
1,2 10-2
|
1,10 10-2 |
1,02 10-2 |
9,40 10-3 |
8,64 10-3 |
7,32 10-3 |
5,72 10-3 |
4,48 10-3 |
Donner l'expression de la vitesse de la réaction
en fonction de k, constante de vitesse, et des
concentrations [H2Y2-] et
[Cr3+].
Vitesse de formation du complexe v= k
[H2Y2-]
[Cr3+].
|
Montrer que la concentration
[H2Y2-] peut être
considérée comme constante. Donner alors
une expression simplifiée de la vitesse de
réaction, en introduisant une constante k'
égale à
k[H2Y2-]0.
H2Y2-est en large excès
devant Cr3+ ;
[H2Y2-] peut être
considérée comme une constante égale
à
[H2Y2-]0
par suite v = k
[H2Y2-]0
[Cr3+] = k'[Cr3+].
Vérifier que la loi cinétique est alors
du type: log(C0/C) = k't par une
méthode graphique.
Donner la valeur de k'. Préciser son
unité.
t(min)
|
0
|
10
|
20
|
30
|
40
|
60
|
90
| 120
|
C0/C
|
1
|
1,09
|
1,10
|
1,28
|
1,39
|
1,64
|
2,10
| 2,68
|
log(C0/C)
|
0
|
3,76 10-2
|
4,14 10-2
|
0,106
|
0,143
|
0,215
|
0,321
| 0,428 |
k' = log(C0/C) / t ( min-1)
|
xxx
|
3,76 10-3 |
2,07 10-3 |
3,53 10-3 |
3,57 10-3 |
3,58 10-3 |
3,57 10-3 |
3,57 10-3 |
k'= 3,5
10-3
min-1.
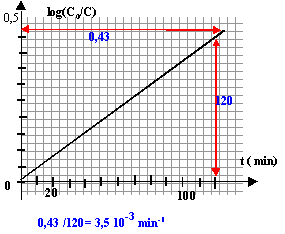
La courbe est une droite, donc la loi
log(C0/C) = k't est bien
vérifiée.
|
|