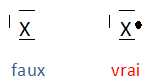|
QCM chimie : concours technicien police scientifique 2003. |
|||||||
|
|||||||
|
D'après la méthode VSEPR le carbone fonctionnel de la diméthylformamide est dans une configuration : A) Plan triangulaire (Vrai) ; B) tétraèdrique (faux) ; C) Pyramidale à base triangulaire (faux). On donne les potentiels d'oxydo-réduction des couples : E°(Cu2+/Cu+) = 0,15 V ; E°(Cu+/Cu) = 0,52 V ; E°(Cu2+/Cu) = 0,34 V. A) En présence du métal, l'ion cuivre (II) Cu2+est plus oxydant que l'ion cuivreux Cu+ (faux). E°(Cu+/Cu) > E°(Cu2+/Cu) : Cu+ est un oxydant plus fort que Cu2+. B) L'ion cuivreux ne peut exister en solution car il conduit à la formation d'ion cuivriques et à un dépôt de cuivre métallique. (Vrai) C) La dilution de la solution d'ion Cu+ précédente rend la solution moins oxydante. (Vrai) E = E°(Cu+/Cu) +0,06 log [Cu+]. Si [Cu+] diminue par dilution, E décroît. En présence d'ion cuivrique, le zinc s'oxyde en ion Zn2+ selon la réaction : Cu2+ + Zn --> Zn2+ +Cu. En présence d'ion Ag+, il s'oxyde en ion Zn2+ selon la réaction : 2Ag+ + Zn --> Zn2+ +2 Ag. En présence d'ion Ag+, le cuivre s'oxyde en ion Cu2+ s'oxyde suivant la réaction : 2Ag+ + Cu --> Cu2+ +2Ag. On constate par ailleurs qu'une lame de zinc plongée dans une solution de sulfate de fer (II) se recouvre de fer, alors que le cuivre et l'argent sont sans réaction sur les ions ferreux A) Le zinc est moins réducteur que le cuivre et le fer (faux). B) Le pouvoir réducteur augmente dans le sens Ag< Cu < Zn. (Vrai). C) Le pouvoir réducteur du fer est intermédiaire entre ceux du cuivre et du zinc. (Vrai). D) En présence d'ion cuivrique, le fer se recouvre d'une couche de cuivre. (Vrai). deux métaux M1 et M2 sont caractérisés en présence de leurs ions respectifs M1n1+ et M2n2+ par les potentiels d'oxydo-réduction E1 et E2 tels que E1 > E2.On réalise une pile dont chaque compartiment est constitué d'une électrode du métal plongeant dans une solution de ses ions. A) le pôle négatif de la pile est l'électrode du métal M1. ( faux ). ( E1 > E2, M2 est le métal le plus réducteur, il s'oxyde et cède des électrons : il constitue la borne négative de la pile). B) La force électromotrice de la pile est DE =E1-E2 . (Vrai). C) M2 est plus réducteur que M1. (Vrai). D) On observe aux deux électrodes les réactions suivantes : M1--> M1n1+ + n1e- ; M2 +n2e---> M2n2+ . (faux). M2 s'oxyde : M2 --> M2n2++n2e- ; M1n1+ se réduit : M1n1+ + n1e- =M1. A) Lors du dosage d'un acide faible par une base forte, le pH à la demi-équivalence est égal au pKa de l'acide. (Vrai). B) La force d'un acide est d'autant plus petite que la constante d'acidité Ka du couple acide / base est plus faible. (Vrai). ( il faudrait préciser " à concentration égale"). C) L'ammoniac est une base forte. (faux). D) L'ammoniac réagit totalement avec l'eau. ( faux). La constante de réaction K entre l'acide A1 d'un couple de constante d'acidité Ka1 et la base B2 d'un couple d'acicité Ka2 < Ka1 est : A) Supérieure à 1. (Vrai). A1 est l'acide le plus fort ( Ka1 >Ka2 ); B2 est la base la plus forte. B) Inférieure à 1 (faux). C) La réaction entre A1 et B1 est peu avancée vers la droite. ( faux). D) La réaction entre A1 et B1 est très avancée vers la droite. ( faux). Il existe un équilibre entre l'acide A1 et sa base conjuguée B1 de constante Ka1. A) La molécule de propène présente un stéréoisomère de configuration ( faux). Pas d'isomérie Z E. B) La molécule de propène ne présente pas d'isomère de constitution (faux) . Le cyclpropane et le propène sont isomères de constitution. C) Un isomère de configuration possède une infinité de stéréoisomères de conformation. (Vrai). Plusieurs conformations sont possibles par rotation autour d'une liaison simple C-C. D) On peut isoler des isomères de configuration. (Vrai). Pour synthétiser l'ester de formule C2H5-COO-C2H5 on peut utiliser : A) le chlorure d'éthanoyle et le propan-1-ol (faux). B) Le chlorure d'éthanoyle et le propan-2-ol (faux). C) Le chlorure de propanoyle et l'éthanol. (Vrai). D) le chlorure d'éthanoyle et l'éthanol (faux). Les corps gras sont des esters dérivés : du glycol ( faux) ; du glycérol (Vrai) ; de l'acide nitrique (faux) ; d'acides carboxyliques. (Vrai). Soit l'acide propanoïque [ composé (a) ]. A) Il répond à la formule C3H7-COOH ( faux). C2H5-COOH. B) L'action du pentachlorure de phosphore ( PCl5) conduit à un composé B qui est le chlorure d'acéthyle. ( faux). Chlorure de propanoyle. C) Traité par l'ammoniac, le composé B conduit au propanamide CH3-CH2-CO-NH2 et cette réaction est totale. (Vrai).
Considérons la réaction H2O2 + 2I- +2H+ --> 2H2O + I2. Les vitesses de disparition de l'eau oxygénée et des ions iodures sont liées par : V(H2O2) = V(I-) (faux) ; V(H2O2) = 2V(I-) (faux) ; 2V(H2O2) = V(I-) ( Vrai ) ; V(H2O2) = 1/V(I-) (faux). Le pôle négatif d'une pile : A) Correspond à l'anode de ce générateur. ( Vrai ). A l'anode on observe une oxydation qui libère des électrons. B) Correspond au couple redox de plus haut potentiel (faux). Le réducteur le plus fort s'oxyde, le couple red/Ox correspondant a le potentiel le plus faible. C) Est où a lieu l'oxydation du réducteur de son fonctionnement. ( Vrai ). D) à combustible est du côté du combustible. ( Vrai ). Le combustible H2 s'oxyde. On exprime la concentration de l'eau oxygénée en "volumes". Pour la désinfection des plaies, on utilise l'eau oxygénée à 10 volumes. Cela veut dire : A) Qu'il y a 10 volumes d'eau oxygénée pour 90 volumes d'eau pure. (faux). B) Qu'il y a 90 volumes d'eauoxygénée pour 10 volumes d'eau pure. C) Qu'un litre d'eau oxygénée libère par décomposition totale 10 L de dioxygène mesuré à 0°C sous 1 bar. ( Vrai ) D) Qu'un litre d'eau oxygénée libère par décomposition totale 10 L de dihydrogène mesuré à 0°C sous 1 bar. (faux). On peut utiliser sans danger comme gaz propulseur d'un exctincteur : de l'azote ( Vrai ) ; de l'oxygène ( faux) ; de l'hydrogène ( faux) ; du butane (faux). A) Les deux énantiomères d'une molécule chirale ont des propriétés chimiques toujours identiques. ( Vrai ). Seules les propriétés optiques diffèrent. B) le butan-1-ol et le butan-2-ol sont des isomères de chaînes. (faux). La chaîne est identique, les positions du groupe hydroxy OH sont différentes. C) Le 1-phénylpropène (Z) et le 1-phénylpropène (E) sont des diastéréoisomères. ( Vrai ). D) Un atome de carbone asymétrique est tétraédrique. ( Vrai ). Un cultivateur prévoit de cultiver des pommes de terre dans un champ de 3 ha avec un rendement de 4 kg / m2. Le prélevement en élément azote effectué par cette culture est de 170 kg/ha. L'engrais qu'il prévoit d'utiliser est noté 33-10-15. Quelle est la masse d'engrais qu'il doit apporter à son champ, s'il néglige toutes les autres causes de diminution ou d'aumentation de la teneur en azote de son champ ? 5100 kg ; 1545 kg ; 3400 kg ; 765 kg. Masse d'azote prélevée : 170*3 = 510 kg. Puis 510 / 0,33 = 1545 kg. Selon la théorie de Brönsted un acide est une espèce chimique : A) Susceptible de capter un ion hydroxyde. (faux). B) Susceptible de céder un ion hydroxyde. ( faux). C) Susceptible de capter un proton. ( faux). D) Susceptible de céder un proton. ( Vrai ). Sachant que l'univers est composé de 1078 atomes qui sont pour 90 % de l'hydrogène, sachant que la terre a un noyau de 6400 km de rayon et une densité de 5,52, on peut en déduire : ( on donne mH = 1,6710-24 g). A) La terre pèse 6 1021 tonnes. ( Vrai ). Volume de la terre 4/3 p R3 = 4/3*3,14*(6,4 106)3 =1,1 1021 m3. masse volumique de la terre : 5,52 103 kg m-3 ; masse = 1,1 1021 *5,52 103 =6 1024 kg. B) La terre pèse 6 1024 tonnes. (faux). C) Le volume de la terre est 1,1 1012 km3. ( Vrai ). D) La masse de l'univers est environ 12 1045 tonnes. ( faux). 1078 *0,90 *1,67 10-24 =1,5 1054 g = 1,5 1051 kg = 1,5 1048 tonnes. A cela il faut ajouter la masse des 10% des autre atomes. |
|||||||
|
|