|
Dosage H2O2, HPLC, préparation de solution,
spectrophotométrie
:
concours technicien de recherche 2011 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La vanilline peut être obtenue après oxydation de l’acide férulique selon les étapes décrites. 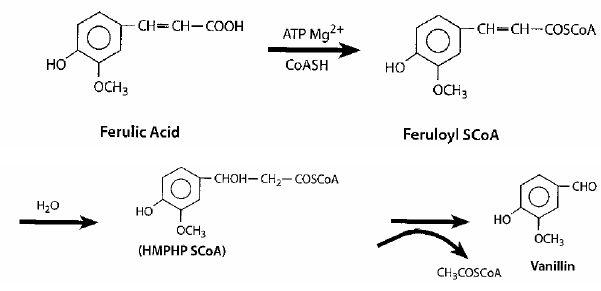 Les métabolites présentés dans la figure sont analysés selon le protocole suivant : "Les métabolites étaient par habitude analysés et quantifiés par HPLC avec un gradient multiphase. Le solvant A était NaOAc, ajusté au pH 6 et le solvant B était MeOH. Le débit était 1,2 ml par minute. La proportion de solvant B est montée linéairement de 0 % à 0 minute à 10 % à 15 minute et ensuite à 50 % à 40 minute et 75 % à 45 minute, diminuant finalement à 0 % à 50 min. La détection : thermoséparation des produits, puis analyse UV de chaque composant." Quelle est la technique séparative utilisée ? HPLC : élution graduée : sur une colonne apolaire, en utilisant une phase mobile eau/méthanol, les composants les plus hydrophobes sont élués avec une concentration élevée en méthanol alors que les composants plus hydrophiles sont élués préférentiellement avec une concentration faible en méthanol. Quel sont les constituants de la phase mobile ? Méthanol et acétate de sodium. La colonne utilisée est elle une phase normale ou inverse ? La phase mobile étant polaire, la colonne est apolaire, donc phase inverse. Quelle est la détection utilisée ? Spectrométrie UV visible. Compte tenu des spectres UV-Vis de certains des composés, à quelle longueur d’onde feriez-vous la détection ? 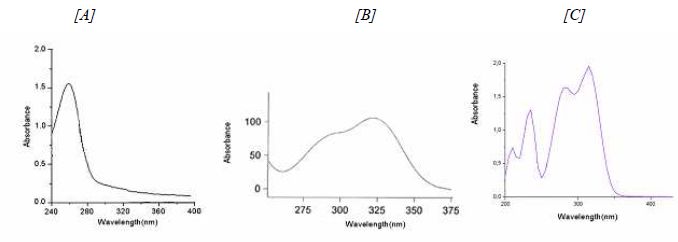 La longueur d'onde choisie doit correspondre à un maximum d'absorption. A : 260 nm ; B : 325 nm ; C : 300 nm. On vous demande de préparer les solutions d’élution. De quel(s) équipement(s) et matériel(s) aurez-vous besoin ? Plusieurs réservoirs contenant les solvants et sels ( tampons ) ; des pompes utilisées pour la circulation de la phase mobile ; un mélangeur. Les temps de rétention des composés et les largeurs des pics à la base sont indiqués :
Dans des conditions chromatographiques données, le "temps de rétention" (temps au bout duquel un composé est élué de la colonne et détecté), caractérise qualitativement une substance. Calculer la résolution entre la Vanilline et le Féruloyl-SCoA. R = 2 (tR a-tR b) / ( w a + w b)=2(34-31,5 ) / (3,1 + 2,5) ~0,9. R étant inférieur à 1,5, les pics seront mal séparés.
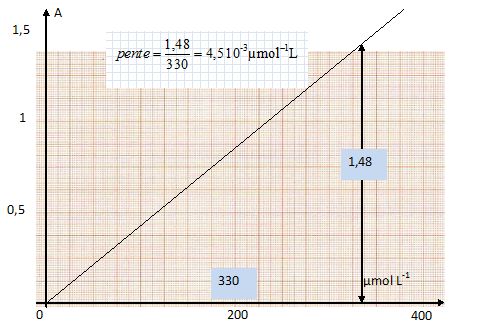
Préparation de solutions. Calculer dans l’eau et à 25 °C les solubilités en mol.L-1 des composés suivants : CaC2O4 ; Ks = 5.10-9= [Ca2+] [C2O42-] = s2 ; s = [Ca2+] =[C2O42-] = (5.10-9)½ =7,1 10-5 mol/L. Ag2CrO4 ; Ks = 4.10-12 = [Ag+]2 [CrO42-]. On pose s = [CrO42-]. La solution est électriquement neutre : [Ag+] = 2[CrO42-] = 2 s. Ks = 4s3 ; s = ( 4.10-12/ 4)1/3 = 1 10-4 mol/L. On dispose des solutions suivantes : C6H5COOH : 0,2 mol.L-1; C6H5COONa : 0,15 mol.L-1 ; pKa ( C6H5COOH / C6H5COONa) = 4,2. Comment peut-on préparer 100 mL de solution tampon de pH 4,7 ? (Donner le détail des calculs). pH = pKa + log [C6H5COONa] / [C6H5COOH] ). On note V le volume de solution d'acide benzoïque et 0,1 -V, le volume de solution de benzoate de sodium. [C6H5COONa] = (0,1-V)*0,15 / 0,1 = 1,5(0,1-V) ; [C6H5COOH] = 0,2 V / 0,1 = 2 V. log [C6H5COONa] / [C6H5COOH] ) = pH - pKa = 4,7 -4,2 = 0,5 ; [C6H5COONa] / [C6H5COOH] =3,16. 1,5(0,1-V) / (2V) = 3,16 ; 0,15 = 3,16 *2V +1,5 V ; V =1,9 10-2 L = 19 mL. Mélanger 19 mL de la solution d'acide benzoïque et 81 mL de solution de benzoate de sodium. Comment contrôlez-vous le pH de la solution obtenue ? Utiliser un pHmètre. Dosage spectrophotométrique de l’anthranilate de méthyle. L’anthranilate de méthyle (AM) est un pesticide servant de répulsif à oiseaux mais également utilisé en parfumerie et dans l’industrie des arômes (on retrouve cette molécule dans les fleurs d’oranger ou de jasmin…). Sa formule semi-développée est donnée : 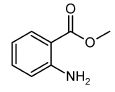 Le dosage à 327 nm avec une cuve en quartz de l = 1 cm donne les résultats indiqués dans le tableau :
Les cuves en quartz sont transparentes dans l'UV. Rappeler la loi de Beer Lambert en définissant chacun de ses termes et en précisant les unités utilisées dans la pratique. La loi de Berr-Lambert exprime la variation de l'intensité lumineuse en fonction de la distance parcourue dans un milieu transparent. Lorsqu'une lumière monochromatique d'intensité I0 traverse un milieu homogène, l'intensité de la lumière émergente I décroît exponentiellement lorsque l'épaisseur l du milieu absorbant augmente. I = I0 . e (- al) a est une constante appelée coefficient d'absorption, caractéristique du milieu et de la longueur d'onde considérés. Dans le cas des solutions, la loi de Beer fait intervenir les concentrations. I = I0 . e (- elc) ou encore A =e l c. où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
Donner la signification des 4 pictogrammes figurant sur l’étiquette. Substance inflammable, toxique, cancérogène ; danger pour l'environnement. Quels sont les risques encourus lors de la manipulation de ce produit ? Intoxication par inhalation, contact cutané, ingestion, peut provoquer le cancer, peut provoquer des brûlures cutanées et des lésions oculaires Quels sont les équipements de protection collective et individuelle à utiliser impérativement ? Port de blouse, gants et lunettes de sécurité ; travail sous hotte aspirante. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|