|
Synthèse
d'un ester : le butanoate de méthyle :
concours Technicien
chimiste Marne la Vallée 2011. |
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
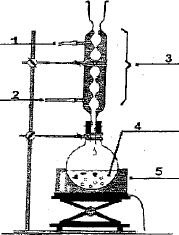
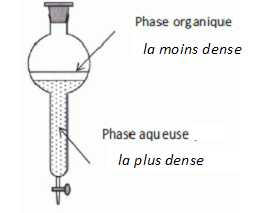
CH3-CH2-CH2-COOH + CH3OH = CH3-CH2-CH2-COO-CH3 + H2O. Estérification. Quel est le rôle de l'acide sulfurique, du chauffage à reflux, de la pierre ponce. L'acide sulfurique est un catalyseur et la pierre ponce régularise l'ébullition. Le chauffage à reflux permet d'accélérer la réaction en travaillant à température modérée tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. Indiquer à quoi sert le lavage de la phase organique. A quoi correspond le dégagement gazeux constaté ? Le lavage avec une solution contenant l'ion hydrogénocarbonate HCO3- , base faible, élimine toute trace d'acide. On observe un dégagement de dioxyde de carbone. La constante d'équilibre de cette réaction est K = 4,1. Dresser le tableau d'évolution du système chimique. Quantité de matière initiale : méthanol 3,2 / (12+4+16) = 0,10 mol ; acide butanoïque : 8,8 / (4*12 +8 +2*16) =0,10 mol.
K =( xf / (0,10-xf))2 = 4,1 ; xf / (0,10-xf) = 2,025 ; xf = 0,2025 / 3,025 = 0,0669 ~0,067 mol. Calculer le rendement par rapport à l'avancement final théorique. Masse théorique d'ester : 0,0669 ( 5*12+10+2*16) = 6,83 g. Rendement : masse réelle / masse théorique = 6,2 / 6,83 = 0,908 ( ~ 91 %).
.
|
||||||||||||||||||||||||||||||||
|
|