.
|
|
Parmi
les précautions énumérées ci-dessous, quelles
sont celles que vous devez prendre pour préparer une solution de
concentration 1M à partir d'acide sulfurique 98 % ?
Vous
mettez un masque. Vous travaillez sous une sorbone.
Vous versez d'abord l'acide puis vous ajoutez de l'eau.
Vous verser le produit dans une fiole contenant de l'eau distillée (
vrai )
Vous mettez des gants ( vrai ). Vous mettez des
lunettes ( vrai ).
Vous
assurez la préparation d'une solution d'acide sulfurique 1 M pour trois
salles de TP contenant chacune 20 postes de travail. Sachant que la
prochaine manipulation nécessitera 20 mL de cette solution pour chaque
poste :
Calculer
la quantité totale de solution à préparer.
3*20*20 = 1200 ml
= 1,2 L.
Quelle
masse d'acide sulfurique 98 % faudra-t-il peser ?
Densité 1,84 ; masse molaire 98 g/mol.
Masse de 1 L d'acide sulfurique 98 % : 1840 g.
Masse d'acide pur : 1840 *0,98 = 1803 g
Quantité de matière d'acide : 1803 * 98 = 18,4 mol ans 1 L.
Facteur de dilution : concentration mère / concentration fille = 18,4.
Volume d'acide 89% à prélever : 1200 / 18,4 = 65,2 ml
Masse d'acide 98% à peser : 65,2 * 1,84 = 120 g.
Décrivez
le mode opératoire.
Pour préparer 1 L de solution 1 M :
Peser
100 g de solution d'acide 98 % ; verser cette solution dans une fiole
jaugée de 1 L contenant au 2 /3 de l'eau distillée. Compléter jusqu'au
trait de jauge avec de l'eau distillée. Boucher et agiter pour rendre
homogène.
Pour synthétiser le butanoate de méthyle, on fait
réagir l'acide butanoïque avec le méthanol. Le mode opératoire est le
suivant :
Dans un ballon, on introduit 8,8 g d'acide butanoïque, 3,2
g de méthanol, 2,0 mL d'acide sulfurique et quelques grains de pierre
ponce. On chauffe à reflux pendant une heure. Le contenu du ballon est
ensuite versé dans de l'eau glacée. On lave trois fois la phase
organique avec une solution d'hydrogénocarbonate de sodium. Aprés
décantation, on obtient 6,2 g de butanoate de méthyle.
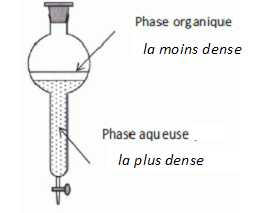
Faire
le schéma du montage réactionnel et de l'ampoule à décanter.
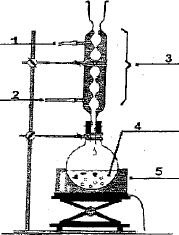
1 : sortie de l'eau ; 2 : entrée de l'eau ; 3 : réfrigérant ; 4 :mélange réactionnel ; 5 : chauffe ballon.
|
 |
|
Ecrire
l'équation de la réaction. Quel est son nom ?
CH3-CH2-CH2-COOH
+ CH3OH = CH3-CH2-CH2-COO-CH3
+ H2O. Estérification.
Quel
est le rôle de l'acide sulfurique, du chauffage à reflux, de la pierre
ponce.
L'acide sulfurique est un catalyseur et la pierre ponce régularise
l'ébullition.
Le
chauffage à reflux permet d'accélérer la réaction en travaillant à
température modérée tout en évitant les pertes de matière : les vapeurs
se condensent dans le réfrigérant et retombent dans le ballon.
Indiquer
à quoi sert le lavage de la phase organique. A quoi correspond le
dégagement gazeux constaté ?
Le lavage avec une solution contenant l'ion hydrogénocarbonate HCO3-
, base faible, élimine toute trace d'acide. On observe un dégagement de
dioxyde de carbone.
La constante d'équilibre de cette réaction est K = 4,1.
Dresser
le tableau d'évolution du système chimique.
Quantité de matière initiale : méthanol 3,2 / (12+4+16) = 0,10 mol ;
acide butanoïque : 8,8 / (4*12 +8 +2*16) =0,10 mol.
|
avancement
(mol) |
CH3-CH2-CH2-COOH |
+ CH3OH |
= CH3-CH2-CH2-COO-CH3 |
+ H2O |
| initial |
0 |
0,10 |
0,10 |
0 |
0 |
| en
cours |
x |
0,10-x |
0,10 -x |
x |
x |
| fin |
xf |
0,10-xf |
0,10-xf |
xf |
xf |
Déterminer
l'avancement final théorique.
K =( xf / (0,10-xf))2
= 4,1 ; xf / (0,10-xf)
= 2,025 ; xf = 0,2025 / 3,025 = 0,0669 ~0,067 mol.
Calculer
le rendement par rapport à l'avancement final théorique.
Masse théorique d'ester : 0,0669 ( 5*12+10+2*16) = 6,83 g.
Rendement : masse réelle / masse théorique = 6,2 / 6,83 = 0,908 ( ~ 91
%).
Une
solution aqueuse d'un monoacide a pour concentration c = 0,01 mol/L ; V
= 100 mL = 0,10 L.
A)
Si la concentration en ion oxonium [H3O+]f
= 0,010 mol/L, alors la dissociation de l'acide est totale ( vrai ).
B) Si le taux d'avancement final t
=1 alors l'avancement final xf =10-3
mol ( vrai
).
Si la réaction est
totale, xf = c v = 0,01 * 0,1 = 10-3 mol.
C) Si la constante d'acidité de l'acide est Ka =
10-3 et que le pH est 4, alors la concentration
en base [A-] est 10 fois supérieure à la
concentration en acide conjugué [AH]. ( vrai ).
pH = pKa + log ( [A-] / [AH] ) ; log ( [A-] / [AH] ) = 4-3 = 1 ;
[A-] / [AH] = 10.
D) Si t = 0,5 alors le nombre de moles d'ion oxonium final est n(H3O+)f = 0,25 mol. ( faux ).
[H3O+]f = n(H3O+)f / V et n(H3O+)f = xf = xmax t = cVt = 0,01*0,1*0,5 = 5 10-4 mol.
Parmi les couples acide / base suivants, quel(s) est (sont) celui (ceux) qui est (sont) correctement écrit(s) ?
A) H2O / H3O+. ( faux ) . H3O+/ H2O.
B) H2O / HO-. ( vrai ). C) H3O+ / HO-. ( faux ). D) HO-/ H3O+. ( faux ).
La relation qui relie le pH d'une solution d'acide faible au pKa du couple AH / A- peut toujours s'écrire :
A) pKa = pH + log ([A-] / [AH] ). B) pH =pKa -[A-] / [AH].
C) pKa = pH + log ([A-] [H3O+]/ [AH] ) ; D) pH =pKa + log ([A-] / [AH] ). ( vrai ).
Soit une solution d'acide AH dont le pKa du couple associé vaut 4,2.
A) L'espèce A- domine à pH = 6,2. ( vrai ).
B) L'espèce AH domine à pH = 5,5. ( faux ).
A pH supérieur à pKa l'espèce A- domine.
C) Les espèces A- et AH sont en quantité égale à pH = 4,2. ( vrai ).
D) Aucune des espèces A- et AH ne prédomine à pH =7. ( faux ).
A pH supérieur à pKa l'espèce A- domine.
Une base est une espèce chimique capable de :
A) D'accepter un proton. ( vrai ). B) De céder un électron. ( faux ).
C) De céder un proton. ( faux ). D) D'accepter un électron. ( faux ).
Soit la réaction d'équation bilan : 2H2O = H3O+ + HO-.
A) Elle correspond à la réaction entre un acide et une base. ( vrai ).
L'eau joue le rôle d'acide : H2O = H+ + HO-. L'eau joue le rôle de base : H2O + H+ = H3O+.
B) La constante associée vaut 10-14 à 25°C. ( vrai ).
C) Elle est appelé autoprotolyse de l'eau. ( vrai ).
D) Elle n'a lieu que dans l'eau pure. ( faux ).
|
|

