.
|
|
On
lit sur l’étiquette d’une boîte d’un détartrant pour cafetière que
chaque cachet de détartrant possède 15 g d’acide sulfamique NH2SO3H.
On dissout un sachet dans 1,00 L d’eau distillée. On obtient une
solution S0. On prélève VA
= 10,0 mL de solution S0 que l’on dose avec une
solution d’hydroxyde de sodium de concentration CB
= 0,1 M en présence d’un indicateur coloré. Il a fallu verser un volume
VE = 15,3 mL de solution d’hydroxyde de sodium
pour atteindre l’équivalence.
Quel
est le rôle de l’indicateur coloré ?
Le changement de couleur de l'indicateur coloré permet de repérer
l'équivalence.
Donner
un schéma légendé du montage permettant de faire le dosage
colorimétrique.
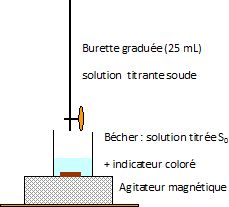
Ecrire
l’équation du dosage sachant que les couples mis en jeu sont :
NH2SO3H(aq)
/ NH2SO3-(aq) et H2O / HO-(aq).
NH2SO3H(aq)
+HO-(aq) -->NH2SO3-(aq) +H2O.
Après
avoir défini l’équivalence, déterminer la concentration molaire
d’acidesulfamique dans la solution S0.
A l'équivalence, les réactifs sont en proportions stoechiométriques.
Avant l'équivalence, l'acide sulfamique est en excès ; après
l'équivalence, la soude est en excès.
[NH2SO3H(aq)]VA
= CB VE ; [NH2SO3H(aq)] = CB
VE / VA
= 0,1*15,3 / 10
=0,153 ~0,15
mol/L.
En déduire
la masse d’acide sulfamique dans un sachet de détartrant.
M(NH2SO3H) =14+2+32+3*16+1 = 97 g/mol.
m = M(NH2SO3H) *[NH2SO3H(aq)]
=0,153 *97 =14,8 g.
|
Pile
et produit de solubilité.
Afin de réaliser une pile, on constitue deux demi-piles qu’on relie à
l’aide d’un pont électrolytique au nitrate d’ammonium (NH4+
+ NO3-). La première
demi-pile est constituée
d’une lame d’argent plongeant dans une solution de nitrate d’argent de
concentration 0,2 mol L-1. La seconde est
constituée d’une lame d’argent plongeant dans une solution de chlorure
d’argent saturée. La première électrode est le pôle positif de cette
pile et la force électromotrice de la pile est U = 0,25V.
Faire
un schéma de la pile.
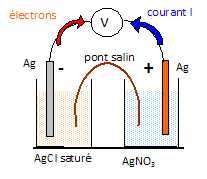
Identifier
l’anode et la cathode ainsi que les réactions mises en jeu.
L'anode négative est le siège d'une oxydation : Ag(s) = Ag+aq
+ e-.
La cathode positive est le siège d'une réduction : Ag+aq
+ e-= Ag(s)
Préciser
le rôle du pont électrolytique.
Le pont salin assure la continuité électrique et la neutralité
électrique des solutions. Il évite le mélange des deux solutions.
Déterminer
les potentiels des deux électrodes.
E1 = E°(Ag+aq /Ag(s) + 0,059 log [Ag+aq]cathode
= 0,80 +0,059 log 0,2 =0,80-0,041 =0,759 ~0,76 V.
E2
= E°(Ag+aq /Ag(s) + 0,059 log [Ag+aq]anode=
E1
-U =
0,76-0,25 =0,51
V.
En déduire
la concentration en ions Ag+ dans la
seconde demi-pile et calculer le produit de solubilité du chlorure
d’argent Ks.
0,059
log [Ag+aq]anode=E2 -
E°(Ag+aq /Ag(s) ; log [Ag+aq]anode=(E2 -
E°(Ag+aq /Ag(s) ) / 0,059
=(0,51-0,80)/0,059 =-4,915
[Ag+aq]anode= 1,215 10-5
~1,2 10-5 mol/L.
Ks = [Ag+aq][Cl-aq] ; la solution est
électriquement neutre : [Ag+aq]=[Cl-aq]
Par suite Ks
= [Ag+aq]2 =(1,215 10-5)2 =1,5 10-10.
En déduire
le pKs et la
solubilité de AgCl en g L-1.
pKs
=-log Ks =-log 1,5 10-10= 9,8.
s = [Ag+aq] M(AgCl) = 1,215 10-5* (108+35,5) =1,7 10-3 g/L.
|
|

