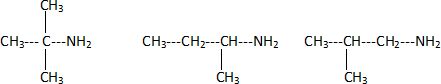L'atome.
Déterminer
les particules qui constituent les atomes ou ions suivants :
3517Cl : 17 protons, 17 élctrons, 35-17 =
18 neutrons.
5927Co : 27 protons, 27 électrons, 59-27 =
32 neutrons.
146C : 6 protons, 6 électrons, 14-6 = 8
neutrons.
13153I : 53 protons, 53 électrons, 131-53 =
78 neutrons.
7935Br- : l'atome compte 35
protons, 35 électrons, 79-35 = 44 neutrons ; l'atome gagne un électron
et donne l'ion bromure (36 électrons ).
3216S2- : l'atome compte 16
protons, 16 électrons, 32-16 = 16 neutrons ; l'atome gagne 2 électrons
et donne
l'ion sulfure (18 électrons ).
13355Cs+ : l'atome compte 55
protons, 55 électrons, 133-55 = 78 neutrons ; l'atome perd un électron
et donne
l'ion césium (54 électrons ).
6430Zn2+ : l'atome compte 30
protons, 30 électrons, 64-30 = 34 neutrons ; l'atome perd 2 électrons
et donne
l'ion zinc (28 électrons ).
|
|
On admettra
que la masse de l’atome d’aluminium 2713Al est
égale à la somme des masses des particules qui le constituent.
Quelle
est la masse du noyau d’un atome d’aluminium ?
Masse du neutron : mn = 1,6749 10-27 kg ; Masse du proton : mp = 1,6726 10-27
kg ;
masse molaire de l’aluminium-27 : M =
26,9815413 g mol-1 ;
Nombre d’Avogadro : NA = 6,02214199 1023 mol-1
; masse de l'électron 9,1094 10-31 kg.
13 mp +(27-13)mn =(13*1,6726 +14*1,6749) 10-27
=4,51924 10-26 kg .
Quelle est la masse
du cortège électronique d’un atome d’aluminium ? Comparer.
13 * 9,1094 10-31
=1,1842 10-29 kg.
La masse des électrons est négligeable devant la masse de l'atome ou
devant la masse du noyau.
Quelle est la masse
d’un atome d’aluminium ainsi calculée ?
4,51924 10-26
+ 1,1842 10-29
=4,52042 10-26 kg.
Relever la masse
atomique de l’aluminium reportée dans le tableau périodique. Comment
justifie-t-on l’écart de masse ? Citer une utilisation des plus
courantes de ce défaut de masse.
Masse réelle
de l'atome : M / NA= 26,9815413 / 6,02214199 1023= 4,48038943 10-23 g =4,48038943 10-26
kg.
On appelle défaut
de masse d'un noyau la différence entre la masse totale des A nucléons
séparés ( Z protons et A-Z neutrons), au repos et la masse du noyau
formé, au repos.
On appelle énergie de liaison notée El d'un noyau l'énergie
que doit fournir le milieu extérieur pour séparer ce noyau au repos en
ses nucléons libres au repos.
On a constaté que la masse du noyau atomique est inférieure à la somme
des masses des nucléons qui le constituent : ce défaut de masse est lié
à l'énergie de liaison du noyau.
Utilisation : les réactions de fission nucléaire dans les réacteurs
civils produisant de l'électricité.
La masse volumique de l’aluminium est r = 2,7 103 kg m-3.
Quelle
est la masse d’un cube d’aluminium de 2 cm de côté ?
volume du cube V=0,023 =8 10-6 m3.
m = V r = 8 10-6 *2,7 103 = 2,16 10-2 kg.
Combien
ce cube contient-il d’atomes d’aluminium ?
2,16 10-2 / 4,48038943 10-26 =4,82 1023
atomes.
Quelle
est le volume molaire (volume d’une mole) à l’état solide de
l’aluminium ?
M / = 27 10-3 / 2,7
103 =1,0 10-5 m-3mol-1.
|
Comparaison de
divers solvants.
solvant
|
nom
|
µ/D
|
er
|
H2O
|
eau
|
1,85
|
78,5 à
25°C
|
NH3
|
ammoniaque
|
1,50
|
22,4 à
-33°C
|
(C2H5)2O
|
éther
éthylique
|
1,15
|
4,4 à
25°C |
C6H6
|
benzène
|
0
|
2,3 à
25°C
|
Que
représentent les notations µ et e
?
µ : moment dipolaire ; e :
permittivité relative
Indiquer
le caractère polaire ou apolaire et dispersant ou non de chaque solvant.
H2O, NH3, (C2H5)2O
sont des molécules polaires. C6H6 est apolaire.
H2O, NH3 sont des solvants dispersant ( er élévée ).
Un étudiant veut préparer un mélange de deux solvants. Quels sont les
mélanges possibles ?
D'une part H2O, NH3 et d'autre part (C2H5)2O,
C6H6.
Isomères.
Soit la molécule ayant la formule brute C4H11N.
Calculer
le pourcentage massique de chaque atome dans cette molécule.
M =4*12+11+14=73 g/mol.
% C : 48/73*100 =65,7 % ; % H : 11/73*100=15,1 % ; %N : 14/73*100=19,2 %
La molécule possède plusieurs isomères. Donner la définition
du terme « isomère ».
Des isomères possèdent la même formule brute, mais des formules
semi-développées différentes.
On sait que la molécule possède un groupe –NH2. Donner les 4
formules semi-développées des isomères possibles.
CH3-CH2-CH2-CH2-NH2.
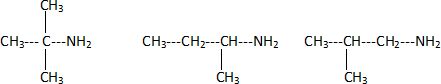
Produits
oxygénés.
On possède 5 flacons contenant les
produits notés A, B, C, D, E tous différents. On ne connaît pas leur
nom mais on sait que :
* chaque produit est un corps pur et sa molécule ne contient que 3
atomes de carbone, des atomes d’hydrogène et 1 ou 2 atomes d’oxygène.
* la chaîne carbonée ne contient pas de liaisons multiples.
* parmi les 5 composés, il y a deux mono-alcools.
On réalise une oxydation ménagée par le dichromate de potassium en
milieu acide des produits A et B et on obtient les résultats suivants :
A conduit à C ou à D alors que B conduit uniquement à E.
Cette
expérience est-elle suffisante pour identifier les 5 produits ?
Justifier.
A est un alcool primaire qui par oxydation ménagée donne un aldehyde ou
un acide carboxylique.
A : propan-1-ol ; C, D : propanal ou acide propanoïque.
B est un alcool secondaire qui donne par oxydation ménagée une cétone.
B : propan-2-ol et E propanone.
On ne peut pas identifier C ou D.
Pour préciser les résultats précédents, on utilise le réactif de
Tollens. On constate que C est oxydé. Identifier les cinq
produits, donner leurs noms et leurs formules semi-développées.
C est un aldehyde, le propanal; D est l'acide propanoïque.
A : CH3-CH2-CH2OH ; B : CH3-CHOH-CH3 ; C : CH3-CH2-CHO ; D : CH3-CH2-COOH ; E : CH3-CO-CH3.
Equilibrer l’équation de la
réaction d’oxydoréduction par le dichromate de potassium en milieu
acide qui fait passer du produit A au produit D.
3 fois{ C3 H8
O +H2O = C3H6 O2 + 4 électrons
+ 4H+}.
2 fois{ Cr2O72-
+ 6 electrons +14 H+ = 2 Cr3+ + 7 H2O}.
3 C3 H8 O +3H2O + 2 Cr2O72-
+28 H+ donne 3 C3H6 O2
+ 4Cr3+ + 12 H+ + 14 H2O
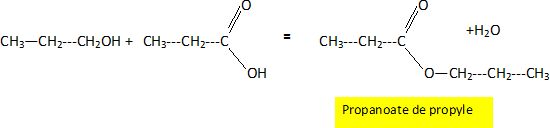
On fait ensuite réagir le produit A avec le produit D. Ecrire
l’équation de la réaction en utilisant les formules semi développées.
Donner le nom du produit organique obtenu. Donnez les
principales caractéristiques de cette réaction.
Estérification lente et limitée par l'hydrolyse de l'ester.
|
|