|
|
La
spectrométrie de masse consiste à vaporiser une espèce ( dont la
molécule est notée M), puis à l'ioniser ( une ou plusieurs fois). Les
ions obtenus sont ensuite accélérés par un champ électrique. Les ions
peuvent rester inchangés ou se scinder en fragments plus petits ( eux
même chargés ou non ). Un dispositif, appelé analyseur, sépare les
différents ions suivant leur rapport masse sur charge m/q où m est la
masse de l'ion et q sa charge. les ions sont récuérés dans les
récepteurs qui génèrent un courant dont l'intensité est proportionnelle
aux nombres des ions détectés.
Un outil informatique permet alors de représenter le spectre de la
molécule M : nombre d'ions en fonction du rapport m/q, généralement
exprimé en thomson ( unité définie un peu plus loin ). On représente le
schéma de principe.

On
donne l'allure d'un tel spectre. L'ion n'ayant pas subit de
fragmentation est désigné par le nom d'ion moléculaire ( ou ion parent
). Dans les spectres, il est fréquent de présenter les abondances
relatives des différents fragments, en assignant la valeur 100 % au pic
le plus important ( qui n'est pas toujours celui correspondant à l'ion
moléculaire ). Enfin un vide poussé est réalisé dans l'appareil.
On définit l'unité de masse atomique, de symbole u, comme étant 1/12e de la masse d'un atome de carbone12C.
On rappelle la définition de la mole : la mole est la quantité de
matière d'une espèce chimique donnée contenant autant d'entités qu'il y
a d'atomes dans 12 g de 12C. NA = 6,02214 1023 mol-1.
Convertir 1 u en kilogramme.
1 u = 12 10-3 /(12* 6,02214 1023 )= 1,6605 10-27 kg.
Convertir la masse d'un proton, d'un neutron, d'un électron en u.
m(p) = 1,67262 10-27 kg ; m(n) =1,67493 10-27 kg ; m(e) = 9,10938 10-31 kg.
m(p) =1,67262 10-27 / (1,6605 10-27 ) =1,007 u ; m(n) =1,67493 10-27 / (1,6605 10-27 ) =1,009 u ;
m(e) = 9,10938 10-31 / (1,6605 10-27 ) =5,486 10-4 u.
Un thomson ( Th) est défini comme le rapport masse sur charge d'une
espèce dont la masse atomique est m = 1 u, et la charge électrique
égale à q = e = 1,602 10-19 C.
Exprimer 1 Th en kg C-1.
1,6605 10-27 / 1,602 10-19 =1,037 10-8 kg C-1.
Pourquoi impose-t-on un vide poussé dans le spectrographe de masse ?
En présence d'air, les chocs des ions sur les molécules d'air dévieraient les ions et fausserait l'analyse.
|
On
cherche à obtenir un ordre de grandeur de la pression. Pour cela on se
repose surla relation suivante qui donne le libre parcours moyen des
molécules d'un gaz en équilibre thermique, c'est à dire la distance
moyenne que parcourt une molécule de gaz entre deux chocs successifs :
L = kBT / (2½P r2).
T température en K, r: rayon d'une molécule, kB=R / NA=1,381 10-23 J K-1 : constante de Boltzamm et P la pression.
Calculer P pour T = 300 K L ~1 m. Vous prendrez un ordre de grandeur réaliste pour le rayon d'une petite molécule.
r ~ 10-10 m . P =kBT / (2½L r2) ~1,381 10-23 *300 / (1,414*3,14*1 *10-20) = 0,09 Pa, soit 106 fois plus faible que la pression atmosphérique.
Il existe plusieurs tchniques d'ionisation. Nous évoquerons les deux suivantes :
L'ionisation électronique
( I.E). Les molécules de l'échantillon gazesont frappées par un
faisceau d'électrons de 70 eV d'énergie cinétique. Il se forme alors
des ions chargés positivement selon :
M+e- ---> M+ +2e- (1).
C'est cet ion moléculaire M+ qui est susceptible de se
fragmenter avant d'arriver au détecteur. La valeur de 70 eV est une
référence, choisie expérimentalement, parce qu'elle donne un grand
nombre de fragments.
L'ionisation chimique
( I.C). La substance à analyser est injectée avec un large excès d'un
gaz noté RH ( méthane ou ammoniac par exemple ). Le gaz ionisé en
premier sous la forme RH+ ionise la substance selon le bilan global :
RH+ + M ---> R +MH+(2).
En général, on obtient quasiment pas de fragments, et donc un seul pic correspondant à l'ion MH+.
Comment nomme-t-on une telle réaction chimique du type 2 ? Donner un exemple d'une telle réaction chimique.
Il y a échange d'un proton : il s'agit d'une réaction acide base.
HO-aq + H3O+aq = 2H2O(l).
On note Mth le rapport masse sur charge de l'ion moléculaire M+ exprimé en thomson. Dans un spectre de masse obtenu par ionisation chimique, quelle sera l'abscisse du pic observé en fonction de Mth ?
On observe un pic moléculaire à Mth+1.
Quelle
information peut-on tirer au sujet de la molécule étudiée, à partir du
spectre obtenu à l'aide d'une ionisation douce ( ionisation chimique )
d'une part, et d'une ionisation dure ( ionisation électronique) d'autre
part ?
Une ionisation douce donne un seul pic et conduit à la masse molaire du
composé étudié. Une ionisation dure donne de nombreux fragments et
conduit à la structure de la molécule analysée.
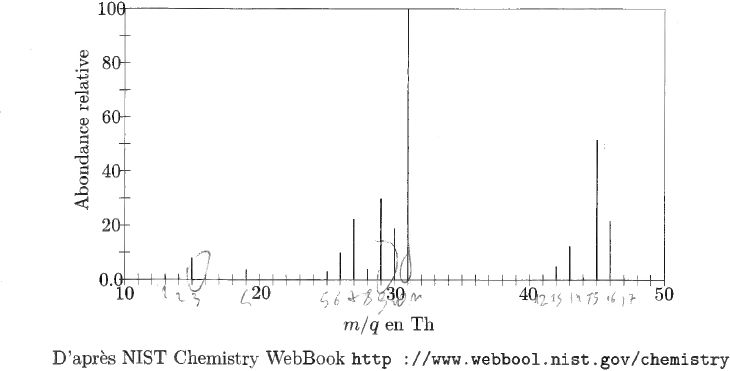
Le spectre représenté ci-dessus est celui d'un alcool. Il a été obtenu par ionisation électronique.
Rappeler
la formule brute d'un alcool dont la molécule contient n atomes de
carbone. Quel est l'alcool dont la figure donne le spectre ?
Monoalcool à chaîne carbonée saturée Cn H2n+2O.
Le pic moléculaire indique une masse molaire M = 46 g/mol soit C2 H6O.
Proposer la structure la plus probable pour les fragments correspondant aux pics les plus importants à 15, 29 et 31 Th.
15 Th : CH3+ ; 29 Th : CH3 -CH2+ ; 31 Th : CH2OH+.
|
Il est fréquent de coupler un spectromètree de masse à un chromatographe en phase gazeuse.
Rappeler le principe et le but de la chromatographie sur couche mince.
La chromatographie permet de séparer et d'identifier les constituants d'un mélange.
La chromatographie sur couche mince met à profit les vitesses
différentes d'élution des constituants par adsorption sur une couche de
silice, phase fixe polaire.
Les spectromètres peuvent donner quasiment en temps réel les spectres des molécules éudiées.
Quel est l'intérêt de ce couplage avec un chromatographe, en particulier dans le cadre de la police scientifique ?
Ce couplage permet d'identifier les molécules d'un mélange et de fournir la composition massique du mélange analysé.
|

