|
.
|
|
On se propose de
synthétiser la molécule (E), qui est utilisée comme arôme artificiel de
banane.
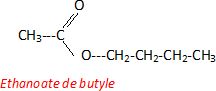
Le composé
(E) est obtenu par réaction entre un acide carboxylique (A) = CH3COOH
et un alcool (B) = CH3CH2CH2CH2OH.
Données :
M(H) = 1,0
g.mol-1 ; M(C) = 12,0 g.mol-1 ; M(O) = 16,0 g.mol-1
;
Masses
volumiques dans les conditions de la réaction : ρ(A) = 1,052 g.mL-1
; ρ(B) = 0,804 g.mL-1 .
pKa
(CH3COOH / CH3COO-) = 4,8 ; pKE
= 14
Nommer (A) et (B).
A : acide éthanoïque ou acétique. B : butan-1-ol.
Comment nomme-t-on
le type de réaction qui intervient entre (A) et (B) ?
L'action d'un alcool sur un acide carboxylique est une estérification.
Ecrire
l’équation-bilan qui permet de synthétiser (E) en faisant apparaître sa
formule semi-développée.
CH3COOH +CH3CH2CH2CH2OH
= CH3COO-CH2CH2CH2CH3
+H2O.
La réaction est menée à
partir de 0,5 mol d’acide (A) à la température de 22°C.
Quel volume de
l’alcool (B) doit-on prélever pour que les deux réactifs soient en même
quantité (mélange équimolaire) ?
n(B) = 0,5 mole ; M(B) =4*12 +10+16 = 74 g/mol.
Masse de B : m = n(B) M(B) = 0,5 *74 = 37 g.
Volume de B : m / rB
= 37 /0,804 = 46,02 ~46 mL
On
peut suivre l’évolution de réaction de synthèse de (E) en dosant la
quantité d’acide (A) restante par une solution aqueuse de soude.
Ecrire
l’équation-bilan du dosage de l’acide (A) par la soude.
CH3COOH aq + HO-aq
---> CH3COO- aq + H2O(l).
Calculer la
constante d’équilibre associée à cette réaction de dosage.
K = [CH3COO-
aq]
/ ([CH3COOH aq][HO-aq]).
De plus Ka = [CH3COO-
aq]
[H3O+aq]/ [CH3COOH
aq]
soit :
[CH3COO-
aq]
/ [CH3COOH aq] =Ka /[H3O+aq]
Par suite : K = Ka /([H3O+aq][HO-aq]) =Ka / KE = 10-4,8
/ 10-14 = 109,2 = 1,6 109. |
.
.
L’évolution de la quantité
d’acide (A) est portée graphiquement :
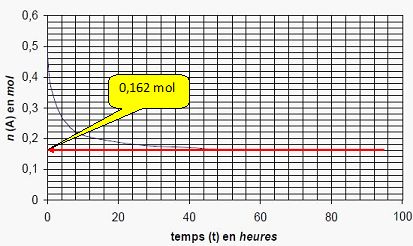
A
l’aide du graphique, déterminer la quantité de (E) finale produite.
n(E) = n(A) initiale - n(A) finale = 0,5 -0,162
=0,338 ~ 0,34 mol.
Déduire de ces
données expérimentales le taux d’avancement final τ.
t = xf /
xmax = 0,338 / 0,5 = 0,676 ~0,68 ( 68 %).
Quelle
quantité d’acide et d’alcool (en mélange équimolaire) devrait-on mettre
en oeuvre pour synthétiser 0,5 mol de E ?
xmax =xf /t = 0,5/ 0,676 ~0,74 mol.
On envisage
de modifier le protocole expérimental.
Indiquer
dans le tableau situé dans le document réponse, l’effet sur
respectivement la vitesse de réaction et/ou le taux d’avancement
: « + » pour une augmentation, « - » pour une diminution et « o » si la
modification de protocole est sans effet.
Modification
effectuée
|
Effet
sur la vitesse de la réaction
|
Effet
sur le taux d'avancement
|
Ajout
de 0,1 mL d'acide sulfurique concentré
|
augmentation
|
sans
effet
|
Ajout
de 0,1 mg de chlorure se sodium
|
sans
effet |
sans
effet |
Ajout
de 50 mL d'eau pure
|
sans
effet |
diminution
Equilibre déplacé
dans le sens indirect
|
Augmentation
de la température
|
augmentation
|
sans
effet
|
|
|