|
|
L'aspartame
:
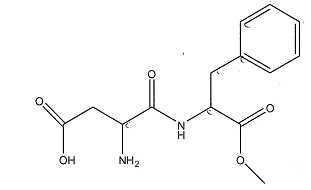
A) La masse
molaire de l'aspartame est 294 g/mol. Vrai.
M(C14H18O5N2) =12*14 +18+5*16+2*14=294 g/mol.
B) La molécule
d'aspartame comporte une fonction alcool. Faux.
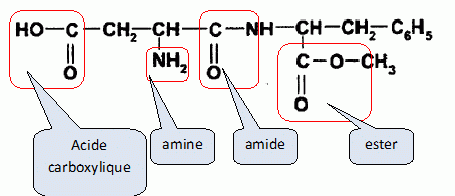
La molécule
possède une fonction acide carboxylique, une fonction amide, une
fonction amine et une fonction ester.
C) La molécule
d'aspartame comporte une fonction ester. Vrai.
D) L'hydrolyse de
l'aspartame produit du méthanol. Vrai.
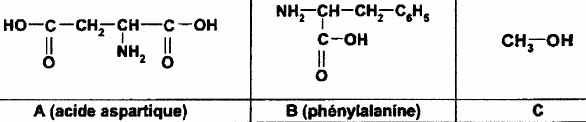
C
est le méthanol.
|
.
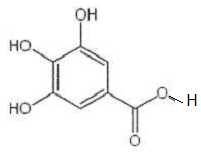
Le
gallate de propyle est un ester obtenu à partir de l'acide gallique et
d'un alcool B.
On réalise un mélange d'une mole d'acide gallique et d'une mole d'un
alcool B. Après addition d'acide sulfurique concentré, le mélange est
chauffé à reflux pendant une heure. On obtient 116 g de gallate de
propyle de formule topologique :
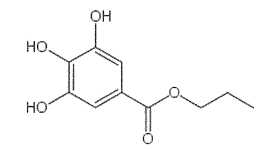
A) L'alcool utilisé est le propan-2-ol. Faux.
B est le
propan-1-ol.
B) La masse molaire
de l'acide gallique est 170 g/mol. Vrai.
M(C7H6O5)
=7*12+6+5*16=170 g/mol.
C) Le rendement
de la synthèse est de 50 %. Vrai.
xmax
= 1 mole ; xréel =106 / M(ester) = 106 / 212=0,5
mole .
D) Ce rendement
est amélioré en utilisant l'alcool en excès. Vrai.
L'excès d'un
réactif déplace l'équilibre dans le sens direct.
La butyrine.
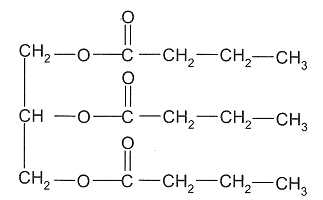
A) La
butyrine est un triester du glycérol. Vrai.
On
fait réagir une mole de butyrine avec un excès de potasse ( K+aq
+ HO-aq) concentrée. Après 30 min de chauffage à
reflux, on observe, après relargage, la formation d'un précipité jaune
de butanoate de potassium. Après filtration, rinçage,
séchage, la masse de précipité est égale à 126 g.
B)
L'hydrolyse
basique est une réaction totale. Vrai.
C) La masse
molaire du précipité est égale à 126 g/mol. Vrai.
CH3-CH2-CH2-COO-
+ K+ : M =12*4+7+2*16+39 =126 g/mol.
D) Le rendement
de cette hydrolyse est de 33 %. Vrai.
Une
mole de butyrine conduit à 3 moles de butanoate de potassium. On obtient
seulement une mole de savon.
|
|





