|
QCM cinétique chimique : concours puissance 11 ( Fesic ) 2012. |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
.
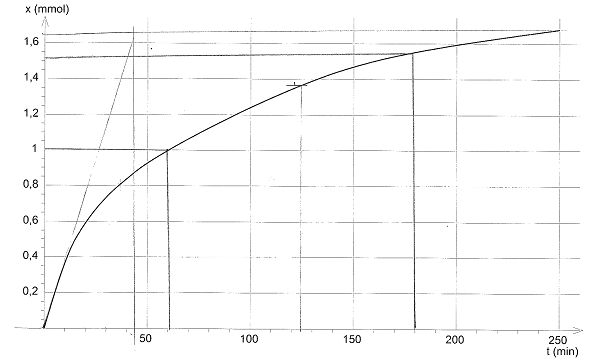
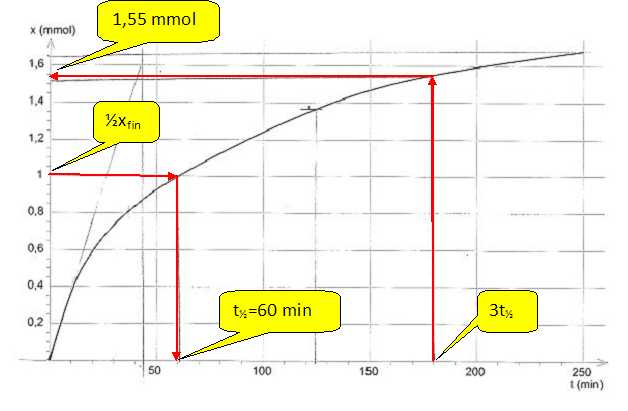
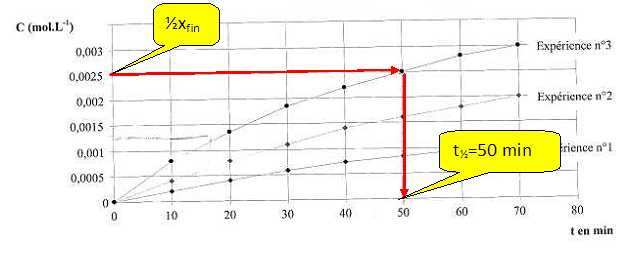
On étudie la cinétique lente et totale des ions iodure I-aq sur les ions peroxodisulfate S2O82-aq. Pour cela on suit l'évolution d'un mélange obtenu à partir de 100 mL d'une solution aqueuse de peroxodisulfate de potassium de concentration molaire c = 0,60 mol/L et 100 mL d'une solution aqueuse d'iodure de potassium de concentration c' = 0,020 mol/L dans trois expériences de conditions différentes : Exp 1 : le mélange est maintenu à la température q1 ; Exp 2 : le mélange est maintenu à la température q2 >q1 ; Exp 3 : on a ajouté quelques gouttes d'une solution contenant des ions fer (III) au mélange maintenu à la température q2. S2O82-aq + 2I-aq = I2aq + 2SO42-aq. Le graphe ci-dessous donne la concentration en diiode C formé en fonction du temps selon les expériennces. 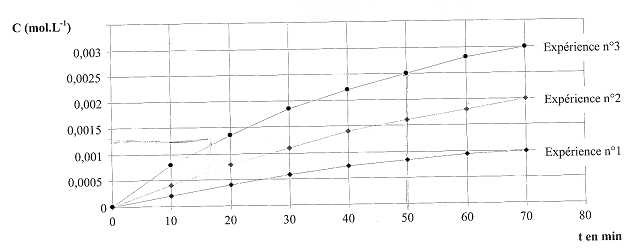 A) La vitesse d'apparition du diiode croît avec la température. Vrai. La température est un facteur cinétique. B) Les ions fer (III) catalysent la réaction étudiée. Vrai. C) Les courbes 1 et 2 n'atteindront pas la même limite que la courbe 3. Faux. Le catalyseur ne modifie pas la composition de l'équilibre, il permet d'atteindre plus rapidement cet équilibre . D) Pour l'expérience 3 le temps de demi-vie est t½ = 50 min. Vrai.
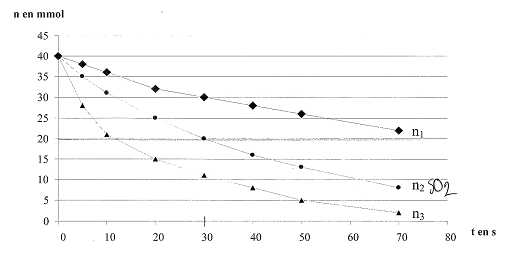
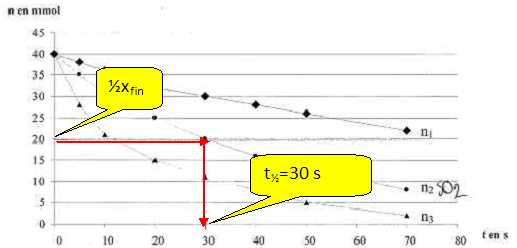
L'oxyde de méthyle ( CH3)2O gazeux se décompose et conduit au cours d'une réaction lente et totale à la formation de méthane CH4, de monoxyde de carbone et de dihydrogène. ( CH3)2O(g) ---> CH4 (g) + CO(g) + H2(g). On suit la cinétique de cette décomposition à température constante. Pour cela on introduit une mole d'oxyde de méthyle dans une enceinte vide, fermée et thermostatée, de volume V constant. A l'instant initial, la pression dans l'enceinte est P0 = 0,400 bar. Au bout de dix secondes,la pression des gaz contenus dans l'enceinte est P = 0,410 bar. A) La pression initiale P0 peut être calculée par P0 = RT / V. Vrai. P0 =n0 RT / V avec n0 = 1 mol. B) A l'état final, la pression dans l'enceinte est égale à 1,60 bar. A partir d'une mole d'oxde de méthyle il se forme une mole de méthane, une mole de CO et une mole de dihydrogène. nfin = 3 mol. Pfin =nfin RT / V = 3 n0 RT / V = 3 P0. Faux. On définit l'avancement x(t) par x(t) = n(H2) formé à l'instant t. C) L'expression de la pression dans l'enceinte à un instant t est : P = P0 +2x(t) RT/V. Vrai. Quantité de matière totale des gaz : n0-x(t)+3x(t) = n0+2x(t). P = (n0+2x(t))RT/V = P0 +2x(t) RT/V. D) Au bout de dix secondes, l'avancement est 0,0125 mol. Vrai. x(t) = (P-P0) V / (2RT) avec P0 = RT/V ; x(t) = (P-P0)/(2P0) = 0,010 / 0,80 =0,0125 mol. |
||||||||||||||||||||||||||||||
|
|