Le
gallate de propyle est un composé organique utilisé contme aditif
alimentaire pour ses propriétés anti-oxydantes; il est identifié par le
code E310. Sa formule semi-développëe est
C6H2(OH)3COO- C3H7.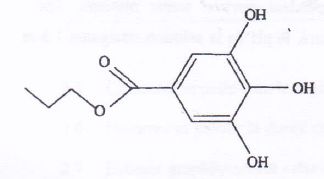
Le gallate de propyle peut êtrc obtenu à partir de l'acide gallique qui
estl extrait du tanin contenu dans les fruits du tara, un arbustre du
Pérou.
|
|
Extraction de
l'acide gallique.
On extrait le tanin de la poudre de tara par dissolution dans I'eau
chaude puis filtration. On ajoute ensuite de I'hydroxyde de sodium
solide NaOH au filtrat jusqu'à obtenir un pH de I'ordre de 11l. On
chauffe alors à reflux en présence de pierre ponce pendant environ
trente minutes. Après refroidissement, on ajoute de l'acide
chlorhydrique concentré, le pH de la solution alteignart 1,5 et l'acide
gallique précipite.
Quel
est l'intérêt du chauffage à reflux ?
En travaillant à température modérée, on accélère une réaction lente.
On évite les pertes de matière : les vapeurs se condensent dans le
réfrigérant et retombent dans le milieu réactionnel.
Ecrire
la formule semi-développée de l'ion gallate.
C6H2(OH)3COO-.
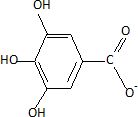
Dans cette question on notera AH l'acide
gallique et A- l'ion gallate.
Ecrire
l'équation modélisant la réaction de l'acide gallique avec l'eau.
AH aq + H2O(l) = A-aq + H3O+aq.
Donner
l'expression de la constante d'acidité Ka du couple AH aq / A-aq.
Ka =[A-aq]éq[H3O+aq]éq / [AH aq]éq.
Calculer
le rapport [AH aq]éq / [A-aq]éq dans la solution à
pH=1,5. En déduire l'espèce dominante.
pKa ( AH aq / A-aq) = 3,1.
[AH aq]éq / [A-aq]éq=[H3O+aq]éq /Ka =10-1,5 / 10-3,1
=101,6 ~40.
A pH inférieur à pKa, AH aq prédomine.
|
.
De l'acide
gallique au gallate de propyle.
On
réalise un métange équimolaire d'acide gallique et d'un alcool B. On y
ajoute de l'acide sulfurique concentré et on chauffe à reflux pendant
une heure. On obtient alors le gallate de propyle.
Quel type
de réaction a-t-on réalisé ? Entourer le groupe caractéristique obtenu
dans la formule du gallate de propyle.
L'action d'un acide carboxylique sur un alcool est une réaction
d'estérification.
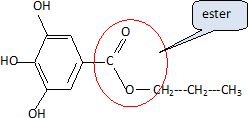
Donner la fonrnrle
semi-développée et le nom de l'alcool utilisé.
CH3-CH2-CH2OH propan-1-ol.
Ecrire
l'équaton de la réaction de synthèse du gallate de propyle.
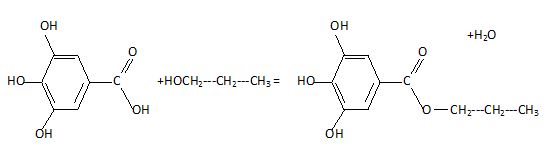
Indiquer
deux caractéristiques principales de cette réaction.
Réaction lente, limitée par l'hydrolyse de l'ester.
Quel est
le rôle de l'acide sulfurique ? De la pierre ponce ?
L'acide sulfurique joue le rôle de catalyseur. La pierre ponce
régularise l'ébullition.
Sachant
que le rendement de la réaction est de 70 %, quelle masse de gallate de
propyle peut-on obtenir à partir d'une masse m = l7 g d'acide.gallique ?
M(acide gallique) =170 g/mol ; M( gallate de propyle) = 212 g/mol.
n(acide gallique )= m / M(acide
gallique) = 17 / 170 = 0,10 mol.
Quantité de matière théorique d'ester : 0,10 mol.
Quantité de matière réelle d'ester : 0,10 *0,7 = 0,07 mol.
Masse d'ester = n(ester) M( gallate de
propyle) = 0,07*212 = 14,84 ~15 g.
|
|



