.
|
|
En
fin d’année, vous devez épuiser les crédits de votre laboratoire. Pour
cela vous décidez de commander du petit matériel. Vous disposez de 1781
€ TTC de crédit. Votre fournisseur vous adresse un devis hors taxe d’un
montant de 1591 €. De combien
doit être la remise (en %) que le fournisseur voudra bien vous
consentir pour que vous puissiez dépenser
au mieux l’intégralité de vos crédits (le taux de TVA est
de 19,6 %).
Crédit disponible hors taxe : 1781 / 1,196 =1489,13 €.
Remise à consentir : 1591-1489,13 =101,87 €.
Soit : 101,87 / 1591*100 =6,4 %.
Sur un banc Kofler (plaque chauffante permettant de déterminer les
points de fusion), on lit les indications suivantes 220V ; 50Hz ; 2kW.
Le câble d’alimentation est composé de 3 fils (bleu, vert-jaune et
rouge). Indiquez
les couleurs conventionnelles pour : la terre ( jaune et
vert) ; le neutre ( bleu ); la phase ( rouge ).
Quelle
est la tension mesurée entre :
La phase et le neutre : 220 V.
La phase et la terre : 220 V. (
zéro volt entre le neutre et la terre ).
Calculez
l’intensité qui traverse la plaque en fonctionnement.
Intensité efficace (A) = Puissance (W) / tension efficace (V) = 2000 /
220 = 9,1 A.
Calculez
la résistance électrique de la plaque.
R = U / I = 220 / 9,1 ~ 24 ohms.
Compléter
le schéma en précisant les noms des différents domaines de
longueurs d’onde (visible, UV, ondes radio, rayons X, IR,
rayons gamma).
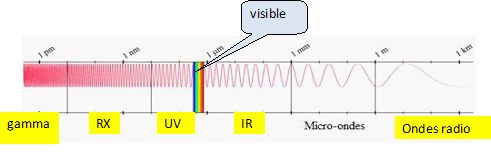
Compléter
les tableaux.
Grandeur
|
Unité
|
Symbole
|
longueur
|
mètre
|
m
|
intensité
|
ampère
|
A
|
fréquence
|
hertz |
Hz
|
pression
|
pascal
|
Pa
|
tension
|
volt
|
V
|
volume
|
mètre cube
|
m3
|
symbole
|
élément
|
symbole |
élément |
N
|
azote
|
K
|
potassium
|
Zn
|
zinc
|
Ag
|
argent
|
Ar
|
argon
|
F
|
fluor
|
He
|
hélium
|
Hg
|
mercure
|
Sn
|
étain
|
P
|
phosphore
|
|
Nom
|
Formule
|
produit
minéral
|
produit
organique
|
caractéristique
|
acide
nitrique
|
HNO3
|
X
|
.....
|
liquide,
acide corrosif
|
acétone ou propanone
|
CH3-CO-CH3
|
.....
|
X
|
solvant
inflammable
|
phosphate de sodium
|
Na3PO4
|
X
|
....
|
sel
solide
|
sulfate
de fer (II)
|
FeSO4
|
X
|
...
|
solide
|
eau oxygénée ou peroxyde d'hydrogène
|
H2O2
|
.....
|
X
|
oxydant,
liquide
|
acide
oxalique
|
HOOC-COOH
|
|
X
|
acide
|
thiosulfate
de sodium
|
Na2S2O3
|
X
|
|
réducteur
|
acide formique
|
HCOOH
|
|
X
|
acide
|
bromure de potassium
|
KBr
|
X
|
|
utilisé
en spectroscopie IR
|
trichlorure d'aluminium
|
AlCl3
|
X
|
|
catalyseur
|
Compléter
et équilibrer les réactions chimiques suivantes.
(COOH)2 + 2
NaOH → (COO-)2 + 2Na+ + 2
H2O.
H3BO3 +2 H2O → B(OH)4-
+ H3O+.
H3PO4 + 3
NaOH → PO43-
+ 3Na+ +
3 H2O.
I2 + 2
S2O32-
→ 2
I- + S4O62-.
6 Fe2+
+ Cr2O72-
+ 14 H3O+
→ 6
Fe3+ + 2
Cr3+ +21 H2O.
Ca2+ + 2
Cl- → CaCl2.
Pb2+ + 2I- →PbI2.
Monographie
en chimie organique: précisez la fonction principale de la molécule et
donnez son nom :
Molécule
|
Fonction
|
Nom
|
C6H5COCl
|
chlorure
d'acyle
|
chlorure
de benzoyle
|
CH3-CHNH2-CH3
|
amine
primaire
|
2-aminopropane
|
| CH3-CH2-CH2-COOH |
acide
carboxylique
|
acide
butanoïque
|
CH2=CH2
|
alcène
|
éthène
ou éthylène
|
CH3-COO-C2H5
|
ester
|
éthanoate
d'éthyle
|
| C6H5CHO |
aldehyde
|
benzaldehyde
|
| CH3-CH2-CH2-CONH2 |
amide
|
butanamide
|
| C6H5OH |
phénol
|
phénol
|
Equilibrez
cette réaction :
Ag+aq + Cl-aq --->
AgCl(s).
Donnez
le nom de la réaction et le nom du produit formé.
Précipitation du chlorure d'argent.
Par
quelle méthode peut-on récupérer le produit formé ?
Filtration.
La réaction d’aluminothermie consiste à faire
réagir l’aluminium métal sur un oxyde, par exemple l’oxyde de fer (III)
Fe2O3.
Écrire
l’équation bilan de la réaction sachant qu’il se forme de l’oxyde
d’aluminium Al2O3 et du fer
métal.
2Al + Fe2O3 ---> Al2O3
+ 2Fe.
On désire obtenir m=500 g de fer. Calculer
les masses d’aluminium et d’oxyde de fer (III) qu’il va falloir faire
entrer en réaction.
Quantité de matière de fer n(Fe) = m / M(Fe) = 500/56 = 8,9286 mol
Quantité de matière d'aluminium n(Al) = n(Fe) = 8,9286 mol
Quantité de matière d'oxyde de fer (III) : n(Fe2O3)
= 0,5 n(Fe) =0,5*8,9286 =4,4643 mol.
Masse d'aluminium : m(Al) = n(Al) M(Al) = 8,9286 *27 =241,0 ~2,4 102
g.
Masse d'oxyde de fer(III) : M(Fe2O3)
= 2*56+3*16 = 160 g/mol.
Masse d'oxyde de fer(III) : n(Fe2O3)
M(Fe2O3) =4,4643*160
=714,3 ~7,1 102 g.
Quelle
est la masse d’oxyde d’aluminium formé ? La loi de Lavoisier est-elle
vérifiée ?
Quantité de matière d'oxyde d'aluminium : n(Al2O3)
= 0,5 n(Al) =0,5*8,9286 =4,4643 mol.
Masse d'oxyde d'aluminium : M(Al2O3)
= 2*27+3*16 = 102 g/mol.
Masse d'oxyde d'aluminium : n(Al2O3)
M(Al2O3) =4,4643*102
=455,4 ~4,5 102 g.
La masse des réactifs est égale à celle des produits : la loi de
lavoisier est vérifiée.
Masses atomiques molaires en g.mol-1 : M(O) = 16
; M(Al) = 27 ; M(Fe) = 56.
Pour fabriquer du chlorure d’hydrogène, on fait réagir du dichlore avec
du dihydrogène.
Écrire
l’équation bilan de la réaction.
H2(g) + Cl2(g) = 2HCl(g).
Quels
volumes de dihydrogène et de dichlore faut-il faire réagir pour obtenir
24 m3 de
chlorure d’hydrogène ? (tous les volumes sont mesurés dans
les mêmes conditions).
Les volumes des gaz sont proportionnels aux nombres stoechiométriques
de l'équation, c'est à dire 1, 1 et 2.
Don 12 m3 de dihydrogène et 12 m3
de dichlore.
Quels
volumes de dihydrogène et de dichlore fait-il pour obtenir une tonne de
chlorure d’hydrogène ? Vm = 24
L/mol ; M(HCl) = 36,5 g/mol ; M(H) = 1,0 g/mol.
Quantité de matière de chlorure d'hydrogène : n (HCl) =1,0 106
/ 36,5 = 2,74 104 mol.
n(H2) = n(Cl2) = ½n(HCl)
= 1,37 104 mol.
V(H2) = V(Cl2) = n(Cl2)
Vm =1,37 104 *24 =3,3 105
L.
En
brûlant 0,528 g de saccharose (composé de C, H et O) on a formé 0,306 g
d’eau et 0,815 g de dioxyde de carbone.
Calculer la composition en pourcentage massique
du saccharose.
Masses atomiques molaires en g.mol-1 : M(H) = 1
; M(C) = 12 ; M(O) = 16.
Formule
du saccharose : CxHyOz.
Masse de carbone dans 0,815 g de CO2 : 12 /
44*0,815 =0,222 g dans 0,528 g de saccharose soit 0,222 / 0,528 *100 =
42,1 %.
Mase d'élément hydrogène dans 0,306 g d'eau : 2 / 18*0,306=0,034 g soit
0,034 / 0,528 * 100 = 6,44 %.
% d'élément oxygène : 100-42,1-6,44 =51,5 %.
Données : pKa : CH3CO2H
/ CH3CO2 -
= 4,8.
On dose un volume VA= 20 mL d’une solution
d’acide éthanoïque de concentration CA par une
solution d’hydroxyde de sodium de concentration CB
=0,1 mol/L. On obtient la courbe (trait plein) ci-dessous pH = f(VB).
Ecrire l’équation bilan de la
réaction de dosage. Calculer sa constante de réaction. En déduire, en
le justifiant, que la réaction est quasi-totale.
CH3CO2H
aq + HO-aq = CH3CO2
- aq + H2O(l).
K = [CH3CO2
- aq]
/ ([CH3CO2H
aq][HO-aq]).
Or Ka = [CH3CO2
- aq][H3O+aq]/ [CH3CO2H
aq] soit : [CH3CO2
- aq]
/ ([CH3CO2H
aq] = Ka
/ [H3O+aq].
Repport dans K : K =Ka
/ ([H3O+aq][HO-aq])
= 10-4,8 / 10-14 = 109,2.
K étant grande, la réaction est totale dans le sens direct.
Définir
l’équivalence acido-basique. Quelles sont les espèces majoritaires (à
part l’eau) présentes dans le mélange réactionnel à l’équivalence ? En
déduire la nature (acide, basique ou neutre) du mélange à l’équivalence.
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
CH3CO2
- aq et Na+aq sont majoritaires à
l'équivalence. Na+aq
n'a aucune propriétés acido-basiques ; CH3CO2
- aq est une base, le pH de la solution sera supérieur à 7.
Déterminer
les coordonnées du point d’équivalence.
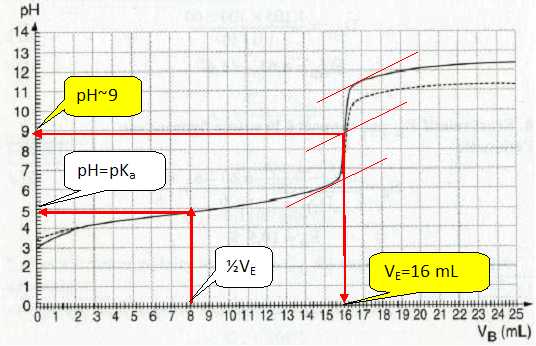
|
Calculer
la concentration de l’acide éthanoïque.
A l'équivalence CA VA = CB
VE ; CA
= CB VE / VA=
0,1 * 16 / 20 = 8,0 10-2 mol/L.
Indiquer
le point de la courbe pour lequel on a CH3CO2H = CH3CO2- . Comment
nomme-ton ce point ? Le mélange correspondant à ce point possède des
propriétés. Lesquelles ?
A la demi-équivalence, pH = pKa. La solution est
une solution tampon.
Celle-ci modère les variations de pH due à l'ajout modéré d'acide ou de
base ainsi qu'à une dilution modérée.
On dilue, au dixième, la solution d’acide éthanoïque et on fait de même
pour la solution de soude. On dose 20 mL de la solution d’acide
éthanoïque diluée par la solution de soude diluée. On obtient alors la
courbe en pointillés sur le même graphe (pour les seuls points où elle
diffère de la courbe précédente). Il est visible, sur le graphe, que le
volume de soude à l’équivalence n’a pas changé. Expliquer.
La dilution est faite en ajoutant de l'eau distillée : celle-ci
n'apporte quasiment pas d'ion oxonium H3O+aq.
En
s’aidant de la courbe, estimer de combien a varié le pH initial de la
solution d’acide éthanoïque. Dans les mêmes conditions de dilution,
quelle aurait été la variation de pH avec un acide fort ?
Lecture du pH initial : en diluant au 1/10è une
solution d'acide éthanoïque, le pH augmente d'environ 0,4 unité pH.
En diluant 10 fois une solution d'acide chlorhydrique, le pH varierait
d'une unité pH.
|

