|
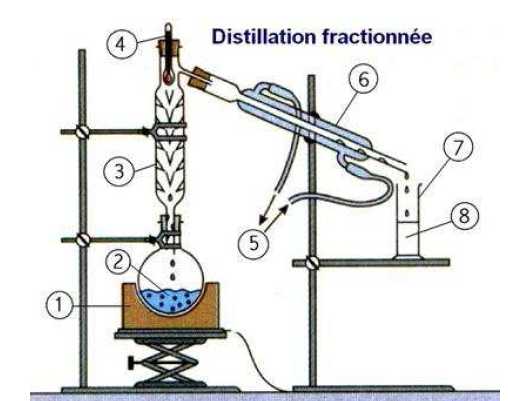
Connaissances du matériel, sécurité : concours ATRF préparateur en chimie Maine 2011. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Quelle est la concentration en mol.L-1 de cette solution commerciale ? Expliquer le calcul. Masse de 1 L de solution : 1,42 kg = 1420 g ; masse d'acide pur : 1420 *0,70 =994 g. Quantité de matière d'acide nitrique : 994 / 63,01 = 15,77 ~15,8 mol dans 1 L. On veut préparer 1L d’une solution d’acide nitrique à 0,2 mol/L. En explicitant les calculs, quel volume d’acide nitrique doit-on prélever ? Facteur de dilution = concentration mère / concentration fille ; F = 15,8 / 0,2 =78,9. Volume de solution mère à prélever : 1000 / F = 1000 / 78,9 = 12,7 mL. Une bouteille de gaz contient de l’oxygène. Son volume est de 150 L. La pression initiale vaut P = 120 bar à la température de T = 25° C. Après utilisation, la pression est p’= 50 bar à la température T’ = 10° C. Calculer la masse d’oxygène utilisée. ( R = 8,31 S.I. M(O) = 16 g.mol-1). Quantité de matière initiale de gaz : n0 = PV / (RT) = 120 *105 *0,150 / (8,31 *(273+25)) =7,2786 102 mol. Quantité de matière finale de gaz : n = p'V / (RT') = 50 *105 *0,150 / (8,31 *(273+10)) =3,189 102 mol. n0 - n = 7,2786 102 - 3,189 102 = 409 mol. Masse d'oxygène : n(O2) M(O2) =409*32 =1,31 104 g ~13 kg.
Définir ce qu’est un EPI ? Citer 3 EPI indispensables en salle de travaux pratiques de chimie. Equipement de protection individuel : blouse, gants, lunettes, chaussures de sécurité. Citer 3 EPI indispensables en salle de travaux pratiques de chimie. Identifier les pictogrammes de sécurité et de signalisation suivants : 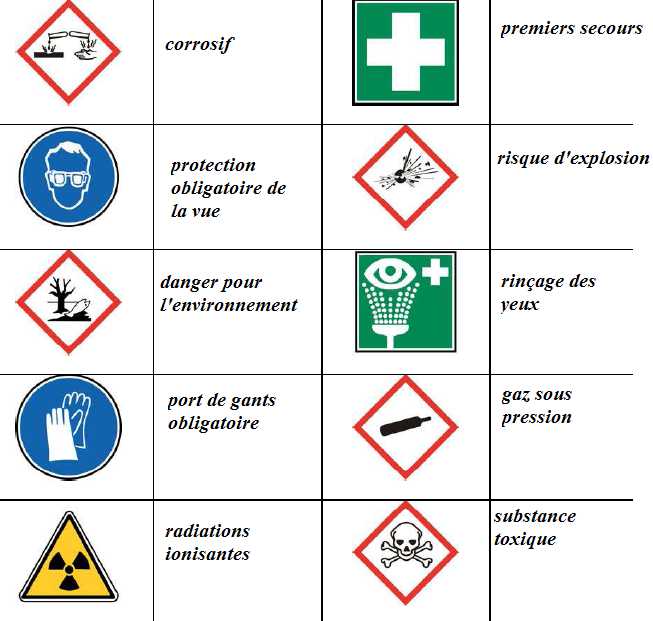 Quels sont les éléments de sécurité indispensables que vous devez repérer quand vous rentrez dans une salle de travaux pratiques pour la première fois ? Les équipements collectifs de sécurité disponibles dans une salle de TP de chimie : extincteurs, douche, couverture, ventilation des salles.
Gestion des déchets. Les produits chimiques suivants sont utilisés au cours des séances de travaux pratiques. Indiquer en cochant la case correspondante s’ils peuvent être éliminés en les jetant à l’évier ou s’il faut les stocker dans des bidons prévus à cet effet (bidon solvant halogéné, bidon solvant non halogéné, bidon acide, bidon base, bidon métaux lourds).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|