.
|
|
Il est interdit de
faire le vide dans :
A) de la verrerie ébréchée ( vrai )
; B) une cloche à vide ; C) une fiole jaugée ; D) un ballon tricol.
En
cas de brûlures quel est le premier geste à effectuer sur la blessure ?
A) Appliquer de
la crème grasse ; B) Appliquer de la glace pendant 10 minutes ;
C) Faire couler de l'eau froide pendant 10 minutes ( vrai ); D) Souffler de l'air froid avec un
ventilateur de labo.
On dispose d'une solution d'acide sulfurique commerciale à 100% et on
souhaite utiliser 100 mL d'une solution acide à 80 %. Pour cela on doit :
A) Verser 20 mL d'eau distillée dans 80 mL de la solution d'acide
sulfurique à 100 %.
Facteur de dilution : F = 100 / 80 = 1,25.
Volume d'acide sulfurique
à 100% : 100 / 1,25 = 80 mL.
Verser l'acide dans l'eau.
B)
Verser 80 mL de la solution
d'acide sulfurique à 100 % dans 20
mL d'eau distillée. ( vrai )
C) Utiliser des lunettes de protection et das gants en caoutchouc pour
réaliser cette manipulation. ( vrai )
D) Utiliser 4 fois plus de solution d'acide sulfurique à 100 % que
d'eau distillée. ( vrai )
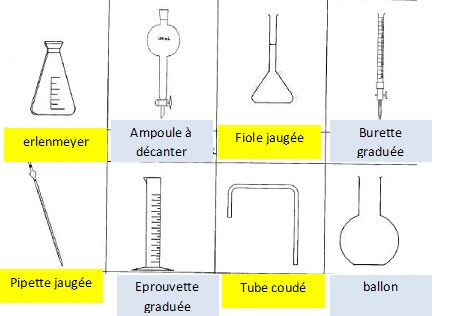
Indiquer le nom de
chaque verrerie sous les images.
|
Les
fabricants indiquent sur chaque flacon de produits chimiques des
pictogrammes pour signaler les différents dangers.
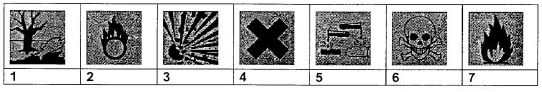
Indiquer
sur les étiquettes suivantes les pictogrammes de sécurité nécessaires
en utilisant les nombres ci-dessus correspondants.

Sur un flacon
d'ammoniac on lit : densité d = 0,95 ; pourcentage massique en ammoniac
30% ; M(NH3) = 17 g/mol.
Pour
préparer 500 mL de solution d'ammoniaque de concentration 1 mol/L, il
faut prélever :
29,9 mL ; 17,9 mL ; 59,8 mL; 5,58 10-2 mL ; 8,97 mL de
solution commerciale.
Concentration de la
solution commerciale :
Masse de 1 L : 0,95 kg = 950 g ; masse d'ammoniaque pure : 950*0,30 =
285 g soit 285/17 = 16,76 moles d'ammoniac dans 1 L.
Facteur de dilution F = 16,76 / 1 = 16,76 ; volume de solution
commerciale à prélever : 500 / 16,76 = 29,8 mL.
Une solution d'eau oxygénée commerciale titre à 110 volumes. On donne à
25 °C : Vm = 24 L/mol ; 2H2O2aq
---> 2H2O(l) + O2(g).
La
concentration de cette solution commerciale vaut : ( en mol/L )
9,17 ; 18,34 ; 4,58.
n(O2) = 110 / 24 = 4,583 mol pour 1 L de solution
commerciale.
n(H2O2aq) =2 n(O2)
= 2*4,583 = 9,17
mol/L.
Après avoir réalisé l'extraction de l'huile essentielle d'orange par
hydrodistillation, on vérifie sa composition à l'aide d'une
chromatographie sur couche mince. L'éluant est constitué d'un mélange à
9 volumes de cyclohexane pour 1 volume d'acétone. Pour réaliser la
préparation de 200 mL d'éluant, il faut mélanger :
A) 10 mL d'acétone et 90 mL de cyclohexane ; B) 90 mL
d'acétone et 10 mL de cyclohexane ;
C) 180 mL d'acétone et 20 mL de cyclohexane ; D) 20 mL
d'acétone et 180 mL de cyclohexane ( vrai ).
Pour s'assurer qu'une huile essentielle contient du limonène et du
citral on procède à une chromatographie sur couche mince. Sur une
plaque de silice imprégnée de substance sensible au rayonnement
ultra-violet on effectue les dépôts suivants : C : citral ; L :
limonène ; H : huile essentielle.
Parmi les
chromatogrammes ci-dessous, quel est celui qui convient ?
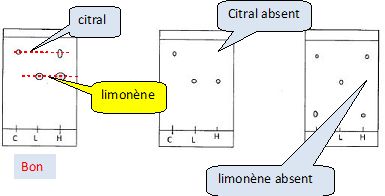
Les taches sont incolores. Citer deux façons de
procéder pour les mettre en évidence.
Exposition à la lumière UV ; utiliser un révélateur : diiode,
permanganate de potassium.
Une enseignante réalise le titrage par conductimétrie de V1 = 50,0 mL d'une solution de sulfate d'aluminium par une solution de chlorure de baryum de concentration C2 = 5,0 10-2 mol/L.
On obtient la courbe ci-dessous :
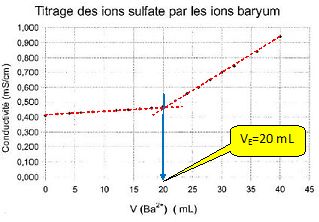
Quel calibre a été choisi pour le conductimètre ? 20 mS/cm ; 2 mS/cm. ( vrai )
Le calibre doit être supérieur à la plus grande valeur ( 0,95 mS/cm ) et le plus proche possible.
Quelle solution a été utilisée pour étalonner le conductimètre ? 12880 µS/cm ; 1413 µS/cm ; 84 µS/cm.
12880 µS/cm = 12,88 mS/cm ; 1413 µS/cm =1,41 mS/cm ; 84 µS/cm = 0,084 mS/cm.
La conductivité de la solution étalon doit être de l'ordre de grandeur de la conductivité mesurée : 1413 µS/cm =1,41 mS/cm.
La courbe permet de retrouver la concentration C1 en ion sulfate sachant qu'ils réagissent mole à mole avec les ions baryum. Choisir la bonne réponse. ( en mol/L) 2,0 10-2 ; 0,2 10-2 ; 1,0 10-2.
A l'équiivalence : C1 V1 = C2 VE ; C1 = C2 VE / V1 = 5,0 10-2*20 /50 = 2,0 10-2 mol/L.
L'enseignante dispose de 20 groupes de TP. Quel
volume de solution de chlorure de baryum faut-il environ préparer
sachant qu'on dispose de fioles jaugées de 50 mL, 200 mL, 500 mL, 1 L
et 2 L.
Pour un groupe il faut 40 mL de solution de chlorure de baryum, d'après le graphe.
Pour 20 groupes : 20*40 = 800 mL ( fiole jaugée de 1 L).
|
|




