.
|
|
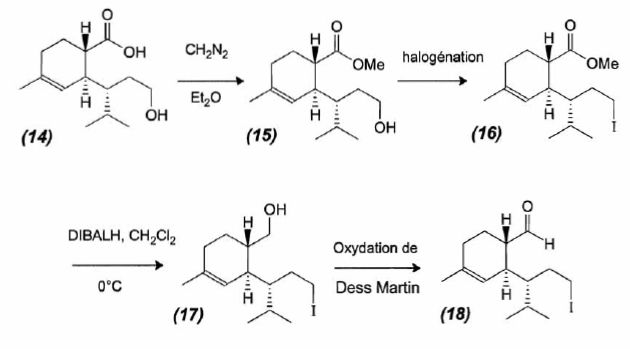
Formation du
composé (18).
Le composé (14) subit la suite de transformation suivante :
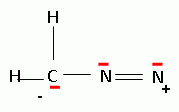
Donner
le schéma de Lewis de la molécule de diazométhane CH2N2.
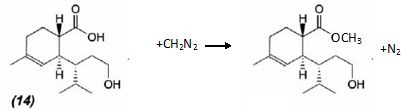
Quel
est le proton le plus acide de la mol&cule (14) ? la
première étape de cette réaction est une réaction acide base entre (14)
et le diazométhane : Ecrire l'équation de
la réaction.
Le proton le plus acide est celui du groupe carboxyle COOH.
Le diazométhane permet de convertir les acides carboxyliques en leur
ester méthylique .
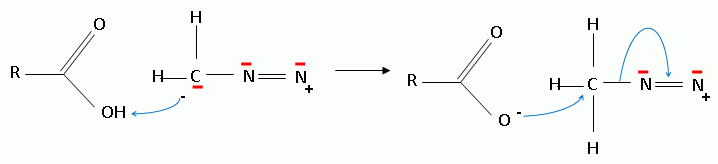
Proposer un
mécanisme pour la formation de (15).
|
Formation du
composé (20).
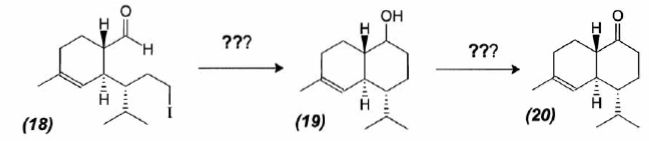
A partir du composé (18) comme seul réactif organique, des solvants et
des réactifs inorganiques nécessaires, proposer une
séquence réactionnelle ( réactifs, solvants, conditions opératoires )
permettant d'obtention du composé (19).
Protonation du carbonyle en milieu acide, à température ambiante ou
modérée, solvant dipolaire aprotique ( DMF ).
Proposer
un réactif permettant le passage de (19) à (20). Quel type de réaction
réalise-t-on ?
Oxydation ménagée d'un alcool secondaire en cétone par une solution
diluée de dichromate de potassium.
Le composé (20) est transformé en composé (21) :
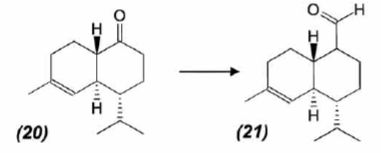
L'action du ter-butanolate de potassium (tBuOK) sur le composé (21)
mène à un anion (22).
Donner la
formule topologique de cet anion et justifier sa stabilité.
tBuO- est une base très encombrée favorisant une réaction
d'élimination. L'atome d'hydrogène en alpha du carbonyle est acide.
L'anion qui résulte de son départ est stabilisé par résonance.
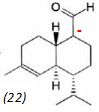
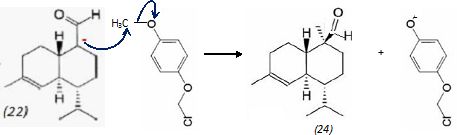
On ajoute à l'anion (22) le composé (23) dont la formule est donnée
ci-dessous ; on isole un composé (24).
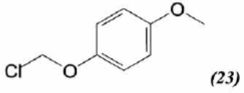
Donner la
formule topologique de (24) ainsi que le mécanisme de sa formation.
Citer un
scientifique ayant participé à la découverte du benzène ou à la
description de sa structure électronique.
1826 : découverte par Faraday ; 1866 : Kékulé propose deux formules
équivalentes.
Après quatre étapes non détaillées, on
obtient le composé (25) de formule brute C16H27NO
qui subit une déshydratation pour donner le sesquiterpène (1) recherché
de formule brute C16H25N.
On donne le protocole opératoire :
6,3 mg du composé (25) sont dissous dans 2,5 mL de dichlorométhane, et
l'ensemble est refroidi à 0°C sous atmosphère inerte. Un excès de POCl3
et de Et3N est ajouté au mélange réactionnel qui est agité
30 min. L'agitation est poursuivie une heure à température ambiante,
puis le mélange est refroidi avec de l'eau froide et extrait à
l'acétate d'éthyle. Les phases organiques sont réunies, lavées avec une
solution de chlorure de sodium à 10 %, puis séchées. Après extraction
du solvant à l'évaporateur rotatif, la purification de (1) par
chromatographie sur colonne de silice ( éluant : acétate d'éthyle 99 ;
éthanol : 1 ) donne 5,5 mg de (1) qui se présente sous l'aspect d'une
huile de pouvoir rotatoire spécifique [a]D =+59,8.
Calculer le
rendement de cette étape.
M(C16H27NO)
=16*12+27+14+16 =249 g/mol ; n(24) = 6,3 / 249 = 0,0253 mmol ; on peut
donc espérer obtenir au plus n(1) max =0,0253 mmol de (1).
M(C16H25N)
=16*12+25+14=231 g/mol ; n(1) réel = 5,5 / 231= 0,0238 mmol.
Rendement : n(1) réel / n(1) max =0,0238 /
0,0253 = 0,94 ( 94 %).
Quel réactif peut-on
utiliser pour sécher la phase organique ?
Sulfate de magnésium anhydre.
Rappeler en quelques lignes le principe
de la séparation par chromatographie sur colonne.
Principe
général de la chromatographie :
La
chromatographie est une méthode de séparation et d'identification des
constituants d'un mélange.
La chromatographie est basée sur la différence de solubilité d'une
substance dans deux phases non miscibles:la phase stationnaire liée au
support et la phase mobile ou solvant.
Plus une substance est soluble dans la phase mobile, plus elle est
entraînée par cette phase; inversement, une substance peu soluble dans
la phase mobile migre peu.
Un fluide appelé phase mobile parcourt un tube appelé colonne. Cette
colonne peut contenir des "granulés" poreux (colonne remplie) ou être
recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les
deux cas, la colonne est appelée phase stationnaire.
A l'instant initial, le mélange à séparer est injecté à l'entrée de la
colonne où il se dilue dans la phase mobile qui l'entraîne à travers la
colonne. Si la phase stationnaire a été bien choisie, les constituants
du mélange, appelés généralement les solutés, sont inégalement retenus
lors de la traversée de la colonne.
De ce phénomène appelé rétention il résulte que les constituants du
mélange injecté se déplacent tous moins vite que la phase mobile et que
leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de
la colonne les uns après les autres et donc séparés.
Un détecteur placé à la sortie de la colonne couplé à un enregistreur
permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige
sur un enregistreur un signal constant appelé ligne de base en présence
du fluide porteur seul ; au passage de chaque soluté séparé il conduit
dans le temps à l'enregistrement d'un pic.
Dans des conditions chromatographiques données, le "temps de rétention"
(temps au bout duquel un composé est élué de la colonne et détecté),
caractérise qualitativement une substance. L'amplitude de ces pics, ou
encore l'aire limitée par ces pics et la prolongation de la ligne de
base permet de mesurer la concentration de chaque soluté dans le
mélange injecté.
C'est en jouant sur la nature de l'éluant (et dans une moindre mesure
sur la nature du support) que l'on parvient à séparer les constituants
d'un mélange.
Quel appareil de
mesure utilise-t-on pour la détermination expérimentale d'un pouvoir
rotatoire ?
L' instrument qui permet de mesurer les rotations optiques est le
polarimètre.
|
|








