.
|
|
Formation du
composé (12).
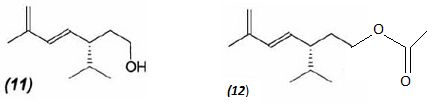
Le composé (11) est traité par l'anhydride éthanoïque, en présence de
triéthylamine Et3N. Après différents lavages, extractions,
on isole le composé (12).
Donner
la formule topologique du composé (12)
 . .
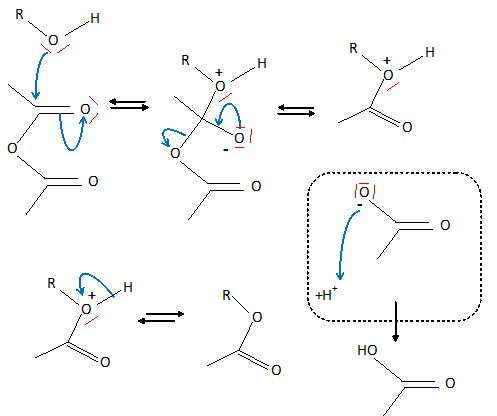
Quel
est le rôle de la triéthylamine ? Proposer un
mécanisme réactionnel pourla formation de (12).
Lors de la réaction d'estérification, il se forme de l'acide
éthanoïque. La triéthylamine est une base qui réagit avec l'acide
éthanoïque formé. L'alcool est noté R-OH.
Formation
du composé 14.
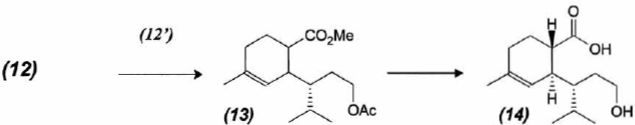
Dans
l'étape (12) --> (13) on réalise une réaction de Diels-Alder entre
(12) et (12'). Le spectre RMN 1H du composé (12'), de formule brute C4H6O2
réalisé dans CDCl3 donne plusieurs massifs regroupés dans le
tableau :
signal
|
déplacement
chimique
|
intégration
|
allure
du signal
|
couplages
|
a
|
3,76
ppm
|
3
H
|
singulet
|
|
b
|
5,83
ppm
|
1
H
|
doublet
de doublet
|
1,5
Hz ; 10,6 Hz
|
c
|
6,14
ppm
|
1
H
|
doublet
de doublet |
10,6
Hz ; 17,4 Hz
|
d
|
6,40
ppm
|
1
H
|
doublet
de doublet |
1,5
Hz ; 17,4 Hz
|
Le spectre
infrarouge de (12') possède entre autres bandes, les bandes
caractéristiques suivantes : 1636 et 1732 cm-1.
|
Donner la formule
topologique de (12'). Attribuer à chaque
signal RMN les protons correspondant. Interpréter les données
infrarouges.
1732 cm-1 : groupe C=O ; 1636 cm-1 : groupe C=C, alcène, conjugué
avec C=O, abaissée par conjugaison.
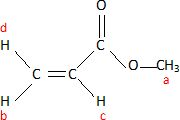
Protons trans Hd et Hc : grand couplage 17,4 Hz ;
protons cis Hb et Hc : couplage moyen 10,6 Hz ;
protons trans Hd et Hb : petit couplage 1,5 Hz.
On observe dans chaque cas un doublet dédoublé : les 4 pics ont la même
intensité.
Ha : aucun proton proche voisin, donc un sigulet.
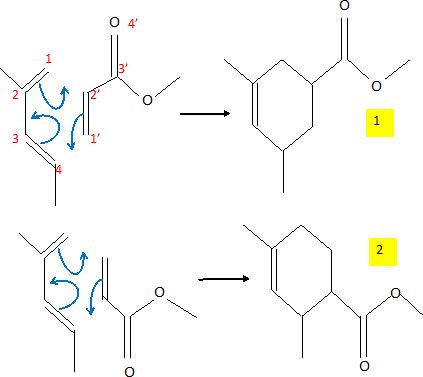
La réaction forme un régioisomère de (13à) minoritaire. Donner sa formule
topologique.
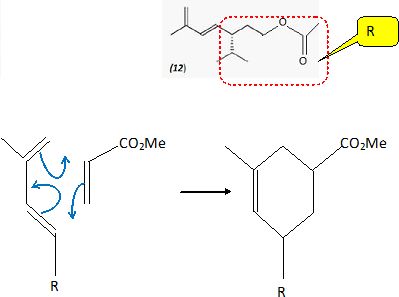
Pour
comprendre la régiosélectivité observée, on se propose d'étudier la
réaction entre l'acrylate de méthyle (A) et le 2-méthylpenta-1, 3-diène
(B). Pour chaque molécule, on donne l'énergie des orbitales frontières
( la plus haute occupée (HO) et la plus basse vacante (BV)) ainsi que
les coefficients relatifs aux orbitales atomiques pour chaque carbone
numéroté i obtenus par la méthode de Hückel simple.
A
|
|
énergie
|
atome
1'
|
atome
2'
|
atome
3'
|
atome
4'
|
BV
|
a-0,436 ß
|
0,67
|
-0,29
|
-0,54
|
0,38
|
HO
|
a + ß
|
-0,58
|
-0,58
|
0
|
0,58
|
B
|
|
énergie
|
atome 1
|
atome 2
|
atome 3
|
atome 4
|
BV
|
a-0,71 ß |
0,55
|
-0,39
|
-0,34
|
0,63
|
HO
|
a+0,48 ß |
0,65
|
0,31
|
-0,40
|
-0,52
|
Donner les deux
produits régioisomères obtenus par réaction de Diels-Alder entre le
composé A et le composé B.
Quel est
l'interaction orbitalaire la plus favorable ? Justifier.
Il faut que les niveaux des orbitales frontières de
A et B soient le plus proche possible.
Faisons le calcul de la
différence des niveaux d'énergie :
DE = BV(diène B)
-HO(A) =a-0,71 ß -(a + ß )= -1,71 ß.
DE = BV(A) -HO(B) =a-0,436 ß -( a+0,48 ß) = -0,916 ß.
Il y a donc interaction entre la BV de A et la HO du diène B.
Quel est le produit
majoritaire ? (2).
L'une des liaisons se forme avant l'autre et détermine donc le sens de
la cycloaddition. La liaison qui se forme le plus facilement est celle
reliant les atomes ayant les plus grands coefficients ( en valeur
absolue ) des orbitales frontières. Le composé obtenu
majoritairement est donc l'isomère 2.
|
|





