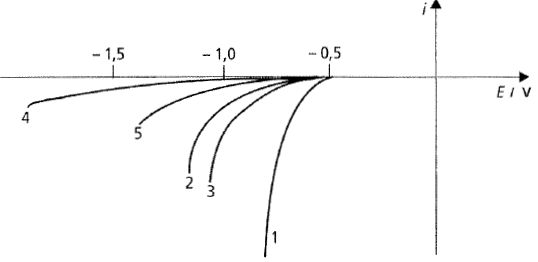
|
Dépôt électrolytique de nickel, protection contre la corrosion : concours Agrégation interne 2011. |
||||||
|
||||||
|
.
La surtension pour la réduction des ions nickel hNi est donnée par la relation : hNi =-0,15 log |jNi| -0,31. Définir et calculer la surtension pour la réduction des ions Ni2+. hNi = EC-E(Ni2+aq / Ni(s)). E(Ni2+aq / Ni(s)) = E°(Ni2+aq / Ni(s)) +0,03 log [Ni2+] = -0,25 + 0,03 log 1 = -0,25 V. hNi = -0,65 -(-0,25) = -0,40 V. Définir et calculer le rendement faradique pour le dépôt de nickel. Densité de courant pour la réduction des ions nickel : log |jNi| = (-0,31 -hNi ) / 0,15 = (-0,31+0,40) / 0,15 =0,6 ; |jNi| = 3,98 ~4,0 A dm-2. Rendement faradique : |jNi| / |j| = 4/5 = 0,80 ( 80 %). Calculer la vitesse de dépôt de nickel en micromètres par minute. On note "e", l'épaisseur du dépôt de nickel et S la surface recouverte : volume de nickel : V = e S. Masse de nickel : m = VrNi = eS rNi ; quantité de matière de nickel : nNi =m / M(Ni) = eS rNi / M(Ni). Quantité de matière d'électrons n = 2 nNi = 2eS rNi / M(Ni). Quantité d'électricité : Q = n F = 2 FeS rNi / M(Ni). Or | jNi |= I / S = 1/S dQ/dt = 2 F rNi / M(Ni) de/dt. de/dt = | jNi |M(Ni) / (2 F rNi). de/dt = 400*58,7 10-3 / (2*96500*8,9 103) =1,37 10-8 m s-1 ~1,4 10-2 µm s-1~0,82 µm min-1. Lors de l'électrolyse, l'anode peut être inerte. Ecrire la réaction qui se produit à l'anode. Le solvant ou les ions chlorures peuvent être oxydés : H2O = ½O2(g) + 2H+aq + 2e-. 2Cl-aq = Cl2(g) + 2e-. L'anode peut être en nickel. Expliquer l'intérêt d'un tel choix. L'anode peut s'oxyder : Ni(s)anode =Ni2+aq + 2e- . D'autre part, réduction à la cathode : Ni2+aq + 2e- = Ni(s)cathode. Bilan : Ni(s)anode =Ni(s)cathode. Si l'anode est du nickel impur, on obtient à la cathode du nickel de grande pureté.
Protection contre la corrosion. Pour certaines pièces de réacteurs nucléaires, pour lesquelles une excellente résistance à la corrosion est nécessaire, on utilise un alliage de nockel, l'iconel 690, contenant 29 % de chrome et 6 % de fer. La figure ci dessous donne la courbe de polarisation représentant log |j| en fonction du potentiel E du métal par rapport à l'électrode standard à hydrogène pour un alliage d'iconel 690 plongeant dans une solution d'acide sulfurique de concentration 0,05 mol/L, contenant des ions chlorure ( 1000 ppm, en masse ).H+aq 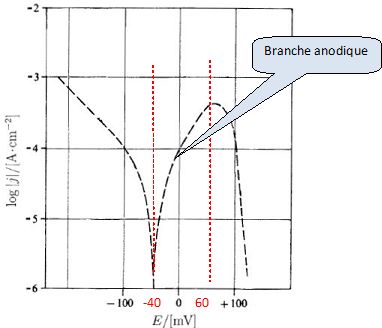 Donner la signification de "ppm". Partie par million. Proposer un moyen de faire comprendre cette signification à un élève de seconde. Dissoudre par exemple 1 mg de sucre dans 1 L d'eau ( 1 kg d'eau) : 1 mg de solide dans 1,0 106 mg de solvant. C'est à dire un million de fois plus d'eau que de sucre. Ecrire l'équation de la réaction électrochimique correspondant à la partie comprise entre -200 et -100 mV de la courbe. Branche cathodique : réduction de H+aq en dihydrogène. 2H+aq + 2e- = H2(g). Indiquer dans quelle partie de la courbe commence l'oxydation du nickel en ions Ni2+. Branche anodique, voir graphe.
|
||||||
|
|