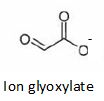.
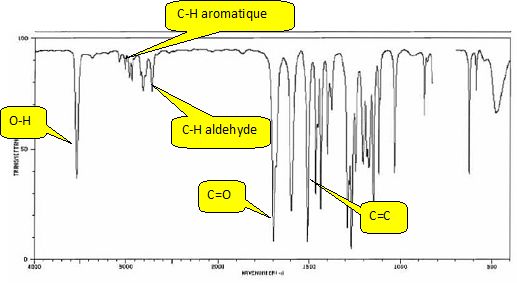
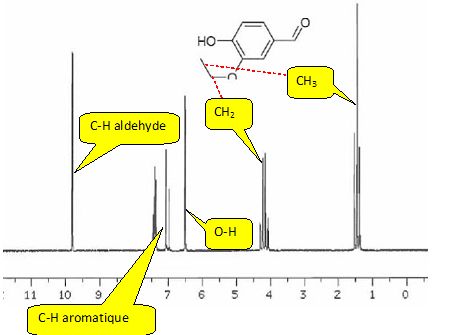
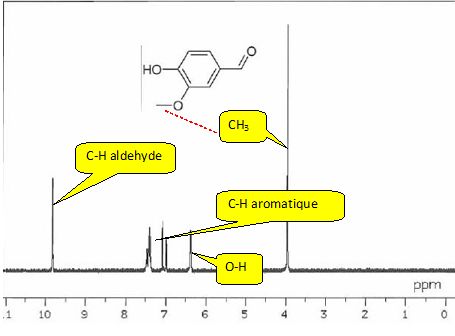
Obtention de la vanilline.
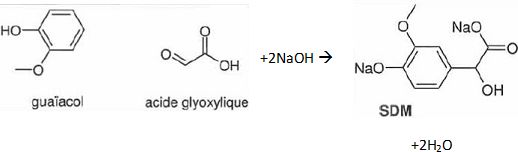
Le 2-méthoxyphénol ( guaïacol), introduit en excès, réagit à 35°C avec
l'acide glyoxylique ( acide 2-oxoéthanoïque ) en présence de soude. On
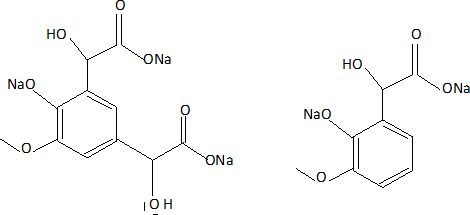
obtient principalement le sel disodique de l'acide
4-hydroxy-3-méthoxymandélique ( noté SDM). Le SDM est alors
partiellement neutralisé à l'aide d'acide sulfurique puis oxydé en
vanilline.
Ecrire l'équation de la réaction d'obtention du SDM.
Substitution électrophile aromatique.
Proposer une structure de l'électrophile mis en jeu dans les conditions basiques de cette synthèse.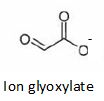
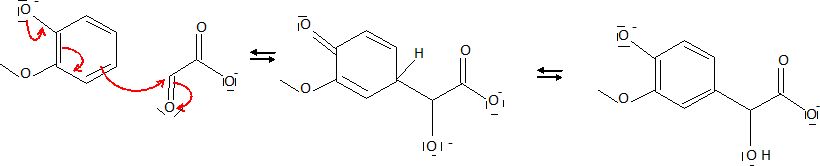
Proposer les étapes élémentaires traduisant la substitution électrophile envisagée.
En
supposant que la réaction est sous contrôle cinétique et en se basant
sur la régiosélectivité observée, comparer le caractère activant des
substituants déja en place. Quels sont les deux produits secondaires
majoritaires prévisibles ?
Les groupe -O- et -OMe sont activant en ortho et para par effet mésomère. La substitution se fait en para du groupe -O- : ce dernier est donc plus activant que -OMe.
Lorsqu'on expose le modèle permettant d'interpréter la régiosélectivité
d'une deuxième substitution électrophile aromatique, on cite souvent
les expressions suivantes : contrôle cinétique, modélisation de l'état
de transition, intermédiaire réactionnel, postulat de Hammond.
Expliciter ces termes et faites le lien entre eux dans le cadre d'une discussion sur la polysubstitution électrophile aromatique.
Contrôle cinétique : les règles de Hollemann permet de prévoir
l'orientation lors d'une seconde substitution électrophile sur le cycle
benzénique. Le produit majoritaire est celui qui est le plus vite formé.
Modélisation de l'état
de transition, intermédiaire réactionnel : l'étape déterminante
conduit à la formation d'un carbocation cyclohexadiénil, intermdiaire
de Wheland, ou ion arénium, instable du fait de la perte d'aromaticité.
Un état de transition ou complexe activé
ayant une durée de vie de l'ordre de 10-13
s ne peut être ni isolé, ni observé
expérimentalement ; sa structure est le fruit
d'hypothèses.
Par contre un intermédiaire réactionnel
ayant une durée de vie assez longue, peut être
observé, voir isolé : sa structure peut don
être connue.
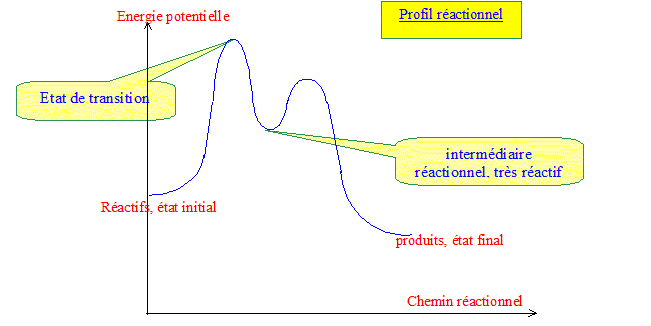
Postulat de Hammond : lorsqu'un état de transition et un intermédiaire
instable, d'énergie voisine, se succèdent dans un processus
réactionnel, leur interconversion ne nécessite qu'une petite
réorganisation des structures moléculaires.
Autre voie de synthèse.
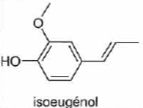
Un protocole opératoire de synthèse de la vanilline part de l'isoeugénol, obtenu par isomérisation de l'eugénol.
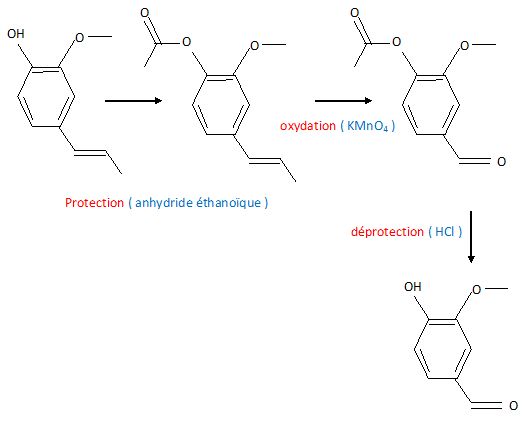
Proposer un schéma réactionnel permettant de passer en quelques étapes de l'isoeugénol à la vanilline.
On
indiquera simplement les différents réactifs et la nature de chaque
étape. On indique que la fonction phénol est sensible aux oxydations et
qu'il faut la protéger.
|
.