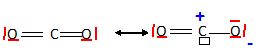|
|
Dissolution du
dioxyde de carbone dans l'eau.
Le
dioxyde de carbone se dissout dans l'eau en donnant une solution, siège
des équilibres suivants, à 298 K :
(1) CO2(g) = CO2(aq) K1° = 3,39 10-2.
(2) CO2(aq) +H2O(l) = H2CO3 (aq) K2° = 2,51 10-3.
(3) H2CO3 (aq) +H2O(l) = HCO3-aq
+ H3O+aq K3°
= 1,58 10-4.
(4) HCO3-aq
+H2O(l) =CO32-aq + H3O+aq
K4° = 5,01 10-11.
Structures
et réactivité.
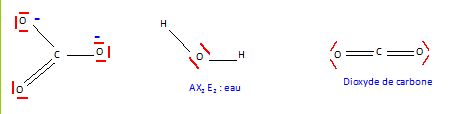
Structure de Lewis.
Représenter une
structure de Lewis pour chacune des espèces suivantes : H2O,
CO2, CO32-.
Dans
l'ion carbonate, peut-on prévoir des longueurs de liaison égales
?
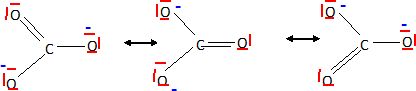
Les structures mésomères ci-dessus permettent de prévoir des liaisons
équivalentes, de longueur intermédiaire entre une liaison simple
et une liaison double.
Approche
orbitalaire et réactivité.
Parmi les orbitales moléculaires ( OM) de CO2 et H2O sont représentées
ci-dessous les HO ( hautes occupées ) et BV ( basses vacantes ).
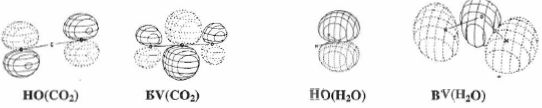
Quelle orbitale
moléculaire traduit la réactivité électrophile de CO2 ?
Est-ce en accord avec la prévision qu'on peut faire à partir de sa
structure de Lewis ?
La réactivité électrophile de CO2 est due à la BV :
celle-ci possède le plus gros coefficient sur le carbone. Cela est en
accord avec la structure de Lewis.
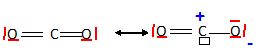
Quelle
orbitale moléculaire traduit la réactivité nucléophile de H2O
? Est-ce en accord avec la prévision qu'on peut faire à partir de sa
structure de Lewis ?
La réactivité
électrophile de H2O est due à la HO : celle-ci possède
le plus gros coefficient sur l'atome d'oxygène.
Cela est en
accord avec la structure de Lewis, seul l'atome d'oxygène possède
des doublets non liants.
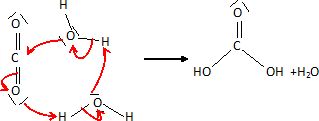
Une étude théorique de la réaction du dioxyde de carbone avec l'eau a
permis d'envisager pour la réaction 2 une étape trimoléculaire où
interviennent deux molécules d'eau ( état de transition cyclique
à 6 centres ).
Schématiser
la réaction du dioxyde de carbone avec l'eau en utilisant le symbolisme
des flèches courbes.
Solubilité de CO2.
Dissolution du dioxyde de carbone contenu dans l'atmosphère.
La pression partielle du dioxyde de carbone dans l'atmosphère est
évaluée à 3,8
10-4 bar.
Evaluer
la quantité de matière de CO2 dissous à
l'équilibre dans 1 L d'eau pure à 25°C. Le résultat obtenu est-il
cohérent avec la mesure du pH d'une eau distillée laissée longtemps à
l'air libre : pH = 5,6 ?
On
note h = [H3O+aq]éq ; PCO2,
la pression partielle en CO2.
(1) CO2(g) = CO2(aq). K1° =[CO2(aq)] / PCO2 = 3,39 10-2 avec PCO2 =3,8 10-4 bar.
[CO2(aq)] =K1° PCO2 = 3,39 10-2 *3,8
10-4 =1,3 10-5 mol/L.
(2) CO2(aq) +H2O(l)
= H2CO3 (aq) K2° =[H2CO3 (aq)] /[CO2(aq)] =
2,51 10-3.
[H2CO3 (aq)] = K2°[CO2(aq)] =2,51 10-3*1,3 10-5 =3,2 10-8 mol/L.
En milieu acide, [CO32-aq]
est négligeable. La solution étant électriquement neutre : [HCO3-aq] =[H3O+aq].
(3) H2CO3 (aq) +H2O(l) = HCO3-aq
+ H3O+aq. K3° = h2 /[H2CO3 (aq)]=1,58 10-4.
h = (K3° [H2CO3 (aq)])½
=(1,58
10-4*3,2
10-8)½ =2,3 10-6 mol/L ; pH
=-log(2,3 10-6) =
5,6.
Cette
valeur est cohérente avec la mesure du pH d'une eau distillée restée
logtemps à l'air libre, l'équilibre étant atteint.
Le
dioxyde de carbone est-il responsable des pluies acides ? Sinon citer
une autre espèce chimique possible.
Le pH d'une pluie acide étant inférieur à 5,6, le dioxyde de carbone
n'est pas le seul en cause. Le dioxyde de soufre et les oxydes
d'azote apportent leur contribution.
|
.
Les
boissons gazéifiées.
On considère une bouteille d'eau, préalablement pure, gazéifiée sous
une pression de CO2 égale à 4,0 bar.
Evaluer
la masse de CO2 contenue dans 1 L de cette eau et le pH
correspondant.
[CO2(aq)] =K1° PCO2 = 3,39 10-2 *4,0
=0,1356 ~0,14 mol/L; m = 0,1356
*M(CO2) ~6,0 g.
[H2CO3 (aq)] = K2°[CO2(aq)] =2,51 10-3*0,1356
=3,4 10-4 mol/L.
h = (K3° [H2CO3 (aq)])½
=(1,58
10-4*3,4
10-4)½ =2,3 10-4 mol/L ; pH
=-log(2,3 10-4) =
3,6.
Le site officiel d'une eau gazéifiée annonce que les bouteilles
contiennent 7 g/L de CO2. Le pH est 5,5.
Comment est-ce
possible ?
L'eau gazéifiée doit contenir d'autres espèces
chimiques : certaines, comme HCO3-, tamponnent le
milieu.
Solubilité de CO2,
influence du pH.
La boisson étudiée contient un acidifiant qui lui confère un pH de 2,5.
Elle contient 5 à 8 g de CO2 par litre.
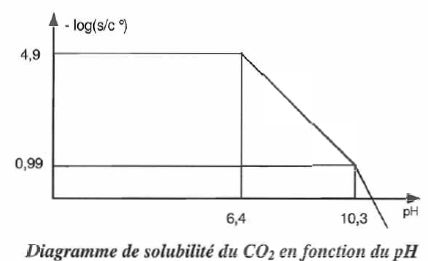
s : solubilité de CO2 et c° = 1,00 mol/L, concentration de
référence.
Donner
l'expression de s en fonction de h=[H3O+] et de
p=PCO2 éq.
s = [CO2(aq)]
+[H2CO3 (aq)]
+[HCO3-aq]
+[CO32-aq].
s =[CO2(aq)]
( 1 +[H2CO3 (aq)]
/ [CO2(aq)]
+[HCO3-aq]/
[CO2(aq)]
+[CO32-aq]/
[CO2(aq)]
).
s = K1° PCO2( 1 + K2° + K2° K3° / h + K2°
K3°K4° / h2).
Retrouver
l'équation du segment de droite situé entre pH = 6,4 et pH = 10,3.
Dans cette zone de pH, HCO3- prédomine : s
~[HCO3-aq]
=K1° PCO2K2° K3° / h.
log s ~ log (K1° PCO2K2° K3°) -log h = log (K1° PCO2K2° K3°) +pH ;
-log s = -log (K1° PCO2K2° K3°) - pH = -log (3,39 10-2 *
3,8 10-4* 2,51
10-3* 1,58 10-4 ) -pH =11,3 -pH.
Evaluer
la pression à l'intérieur de la bouteille.
5 / 44 = 0,1136 mol/L ; 8/44 =0,1818 mol/L d'où 0,11 < [CO2
aq] < 0,18 mol/L.
PCO2 = [CO2 aq] /K1°
; 0,1136 /(3,39 10-2)
< PCO2
< 0,1818 /(3,39 10-2)
; 3,4 < PCO2
< 5,4 bar.
Evaluer
la solubilité du CO2 dans cette boisson laissée à l'air libre,
à l'équilibre thermodynamique en admettant que le pH ne change pas.
A pH= 2,5, -log s = 4,9 ; s ~1,3 10-5 mol/L.
|
L'expression du potentiel
chimique d'un gaz parfait est µgaz = µ°gaz + RT
ln (Pgaz / P°) où P° désigne la pression standard et Pgaz
la pression partielle du gaz considéré.
Comment
est modifiée l'expresion du potentiel chimique dans le cas d'un gaz
réel ?
On remplace la pression partielle du gaz par la fugacité f du gaz. Pour
des pressions inférieures à 10 bar, CO2 peut être assimiler
à un gaz parfait.
Donner
l'expression du potentiel chimique de CO2aq en prenant la
référence " soluté infiniment dilué" dans l'échelle des concentrations.
Etablir
la loi de Henry pour le dioxyde de carbone.
µsol = µ° sol + RT ln [CO2] / c°) ;
à l'équilibre chimique : µgaz =µsol.
µ°gaz + RT ln (Pgaz / P°) = µ° sol +
RT log [CO2] / c°) ; ln (Pgaz / P°) =(µ° sol
-µ°gaz + ) / (RT) + ln [CO2] /
c°).
Pgaz = P° [CO2] / c° exp((µ° sol -µ°gaz
+ ) / (RT)).
Une étude de l'influence de la température T sur la valeur de K1°
fournit les résultats suivants :
T(°C)
|
5
|
10
|
15
|
20
|
25
|
30
|
| pK1° |
1,20
|
1,27
|
1,34
|
1,41
|
1,47
|
1,54
|
On définit et
calcule les grandeurs X = 1/T ( K-1) et Z = ln K1°.
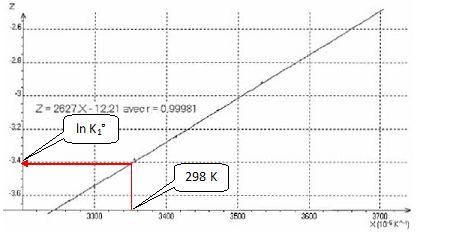
Prévoir
qualitativement le signe de l'enthalpie standard de dissolution du
dioxyde de carbone dans l'eau.
K1° et en conséquence [CO2(aq)], croît
quand la température diminue. K1° =[CO2(aq)] / PCO2. La dissolution de CO2 est donc
exothermique. DrH°
< 0.
Evaluer
numériquement l'enthalpie standard de dissolution du dioxyde de carbone
dans l'eau.
Intégrer la loi de Van't Hoff en faisant l'approximation
d'Ellingham :
d (ln K1°) / dT = DrH° / (RT2)
; ln K1°T2 - ln K1°T1
= -DrH°
/ R ( 1/T2 - 1/T1).
Equation de la droite ci-dessus : ln K1° = 2627 / T-12,21 ;
par identification : DrH° / R = -2627 ; DrH° = -2627*8.31 =
-2,18 104 J / mol.
Prévoir
le signe de l'entropie standard de cette dissolution et l'évaluer
numériquement.
Les molécules de dioxyde de carbone sont solvatées en solution, ce qui
correspond à une diminution du désordre DrS° <0.
DrG° = DrH°
- T DrS° = -RT
ln K1° ; DrS° = R
ln K1° +DrH°
/ T = 8,31 * (-3,4) +(-2,18 104 /
298) = -101 J mol-1 K-1.
Evaluer les pertes de
matière en
dioxyde de carbone ( mol) d'un litre de boisson en équilibre avec la
pression en dioxyde de carbone dans l'atmosphère lorsque la boisson est
chauffée à 100 °C.
ln K1° = 2627 / 373 -12,21 = -5,167 ; K1° =5,7 10-3. [CO2(aq)] =K1° PCO2 = 5,7 10-3 *3,8
10-4 =2,17 10-6 ~2,2 10-6 mol/L.
Perte : 1,3 10-5 - 2,2
10-6 =
1,1 10-5 mol.
|
|