Certains
pécheurs utilisent l'acétate d'amyle pour réaliser des amorces à
gardons, petits poissons de nos rivières. Cet ester peut être
synthétisé par une réaction entre l'acide éthanoïque et le pentan-1-ol
CH3-(CH2)4-OH.
|
|
|
M(g/mol)
|
r(g/mL)
|
solubilité dans l'eau
|
acide éthanoïque
|
60
|
1,05
|
totale
|
pentan-1-ol
|
88
|
0,81
|
faible
|
acétate d'amyle
|
130
|
0,88
|
faible
|
eau
|
18
|
1,00
|
|
cyclohexane
|
84
|
0,78
|
insoluble
|
Ecrire l'équation chimique de synthèse de l'acétate d'amyle.
CH3-COOH + CH3-(CH2)4-OH = CH3-COO-(CH2)4-CH3 + H2O.
Donner les caractéristiques de la réaction d'esterification.
Lente, limitée par l'hydrolyse de l'ester, athermique.
On introduit dans un ballon un volume V1 = 8,6 mL d’acide éthanoïque de masse volumique r1 et un volume V2 de pentan-1-ol de masse volumique r2. On ajoute une pointe de spatule d’acide paratoluène sulfonique et quelques grains de pierre ponce. On chauffe ce mélange à reflux pendant environ 50 minutes. Après refroidissement, le contenu du ballon est traité et on recueille à la suite de plusieurs opérations une masse m = 11,7 g d’acétate d’amyle.
Établir, en fonction des données, l’expression littérale du volume V2 de pentan-1-ol utilisé pour que le mélange (acide carboxylique – alcool) soit équimolaire.
Quantité de matière d'acide éthanoïque : n = V1r1 / M(acide éthanoïque).
Quantité de matière de pentan-1-ol : n = V2r2 / M(pentan-1-ol).
V1r1 / M(acide éthanoïque) = V2r2 / M(pentan-1-ol)
V2 =V1r1 M(pentan-1-ol)/ ( r2 M(acide éthanoïque))
Calculer la valeur de V2.
V2 =8,6 *1,05 *88 / (0,81*60) =16,35 ~16 mL.
L’acide paratoluène sulfonique est un catalyseur de la réaction d’estérification.
Préciser le rôle du catalyseur.
Un catalyseur accélère la réaction d'estérification ainsi que la
réaction inverse d'hydrolyse sans modifier la composition du mélange à
l'équilibre.
Nommer les éléments du montage repérés.
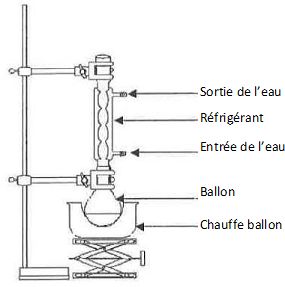
|
Quels sont les intérêts du chauffage à reflux ?
Accélérer la réaction en travaillant à température modérée ( la
température est un facteur cinétique ), tout en évitant les pertes de
matière : les vapeurs se condensent dans le réfrigérant et retombent
dans le milieu réactionnel.
Définir et calculer le rendement r de la synthèse.
r =masse réelle d'ester / masse théorique d'ester.
Quantité de matière d'acide éthanoïque : n = V1r1 / M(acide éthanoïque) = 8,6 *1,05 /60 = 0,1505 mol
A partir de 0,1505 mol d'acide éthanoïque on peut obtenir au mieux 0,1505 mol d'ester soit 0,1505*130 =19,56 g d'ester.
r = 11,7 / 19,56 = 0,60 ( 60 %).
Méthodes d’obtention de l’ester avec un rendement plus satisfaisant :
Utilisation d’un Dean-Stark
Une
méthode consiste à utiliser un appareil de Dean-Stark. Les espèces
chimiques utilisées dans la synthèse précédente sont introduites en
mêmes quantités que précédemment. Le dispositif permet de séparer l’eau
formée du reste du milieu réactionnel, par distillation en présence de
cyclohexane. Le cyclohexane et l’eau formée, non miscible à l’état
liquide, forment un mélange qui s’accumule dans le tube décanteur du
Dean-Stark.
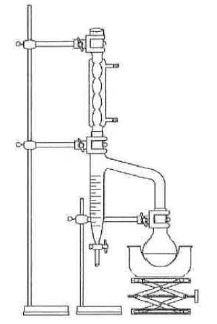
Le tube décanteur de Dean-Stark est rempli de cyclohexane jusqu’à la partie supérieure. Un volume de 10 mL de cyclohexane est aussi ajouté dans le milieu réactionnel. On chauffe à reflux, à ébulllition douce. On suppose que, lors de cette ébullition, seuls l’eau et le cyclohexane s’évaporent.
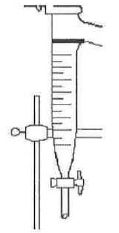
Indiquer les positions relatives des deux phases dans le tube décanteur. Justifier.
Le liquide le plus dense, l'eau dans ce cas, occupe la partie
inférieure. Le cyclohexane, liquide non miscible à l'eau, le moins
dense, occupe la partie supérieure.
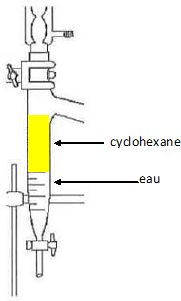
L’eau est extraite du milieu réactionnel au fur et à mesure de sa formation. Quel est l’intérêt de ce dispositif ?
En éliminant l'un des produits au fur et à mesure de sa formation, on
déplace l'équilibre dans le sens direct. Le rendement augmente.
L’expérimentateur observe attentivement le dispositif et décide d’arrêter le chauffage au bout de 50 minutes.
Qu’a-t-il observé qui l’a conduit à prendre cette décision ?
Le niveau de l'eau reste constant dans le tube décanteur quand la réaction est terminée.
En mesurant le volume d’eau obtenue dans le tube décanteur, il en déduit que la masse d’ester formé est m’ = 17,6 g d’ester.
Vérifier l’intérêt de cette méthode par rapport à la précédente en calculant le rendement r’ de la synthèse.
r' = 17,6 / 19,56 =0,90 ( 90 %). Le rendement est bien supérieur à celui obtenu par le simple chauffage à reflux.
Utilistation d’un dérivé de l’acide carboxylique.
Une autre méthode permettant d’obtenir un rendement très supérieur consiste à remplacer l’acide carboxylique utilisé par un de ses dérivés.
Nommer et donner la formule semi-développée de ce dérivé.
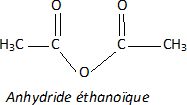
|
|




